Смешение веществ
Один из самых интересных и важных аспектов химии заключается в смешении различных веществ. Иногда во время этого процесса происходит химическая реакция и создается новое вещество. Однако очень часто химической реакции не возникает, но образуется смесь, в состав которой входят уже имеющиеся элементы.
Смеси
Что же такое смесь? Это вещество, компоненты которого перемешаны, но не соединены между собой химической связью.
На первый взгляд такое толкование может показаться довольно странным и непонятным, но давай рассуждать дальше. Если элементы вещества не связаны химически, это означает, что в любой момент их можно разъединить. Это действительно так! Например, если смешать железо с серой, то при помощи магнита можно легко извлечь частички железа, в то время как сера не будет реагировать на магнит.
Притяжение частичек железа магнитом
Основные отличительные признаки смесей:
- смесь можно разделить на отдельные компоненты;
- все компоненты сохраняют свои индивидуальные свойства;
- компоненты в смесях находятся в разных пропорциях.

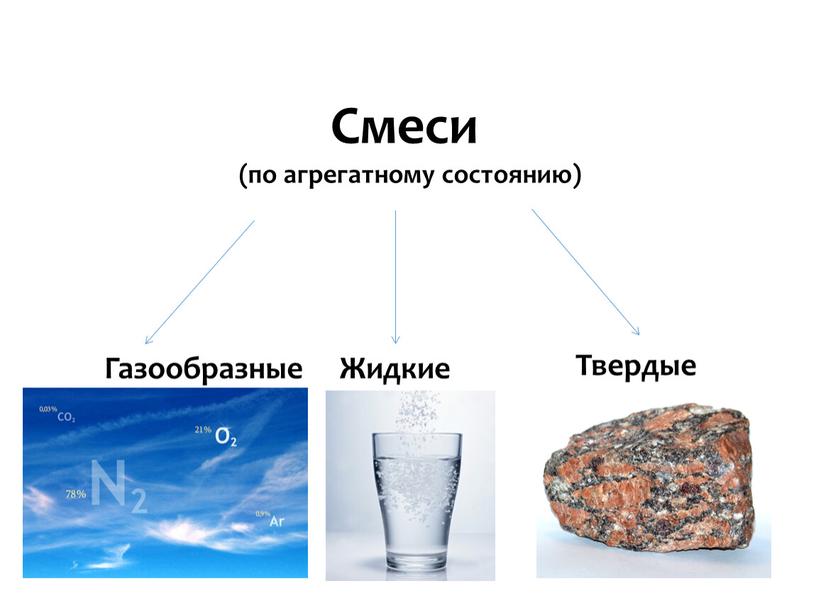
Виды смесей
Смеси могут быть твердыми, жидкими и газообразными. Например, воздух — это смесь газов, соленая вода — смесь жидкости и твердого вещества (соли), а бронза — смесь твердых компонентов (сплав меди и олова).
Каждый компонент смеси сохраняет свои индивидуальные химические свойства, и все компоненты могут находиться в абсолютно любых пропорциях. Например, воздух, которым мы дышим, представляет собой смесь кислорода и других веществ. Их количество может меняться в зависимости от того места, где находится человек. Согласись, что содержание пыли, копоти и прочих вредных веществ на оживленной загазованной улице мегаполиса будет гораздо выше, чем в лесу или парке
Типы смесей
Химики разделяют все смеси на две основные категории: гомогенные, или однородные, смеси и гетерогенные, или неоднородные.
В однородных компоненты равномерно распределены по всей смеси. Примеры — соленая вода, кровь, воздух. В отличие от однородных, в неоднородных смесях компоненты распределены неравномерно. Более того, каждый из них может быть виден в этой смеси. Все однородные и неоднородные смеси делятся на виды: растворы, сплавы, суспензии и коллоидные вещества.
Более того, каждый из них может быть виден в этой смеси. Все однородные и неоднородные смеси делятся на виды: растворы, сплавы, суспензии и коллоидные вещества.
Растворы
Раствором называется смесь, в которой одно из веществ растворено в другом. Самый простой пример раствора — соленая вода, т.е. смесь соли и воды. В данном случае вода выступает в качестве растворителя, а соль — растворимого вещества. Такой раствор очень легко разделить на исходные компоненты путем выпаривания, при этом каждый из них сохраняет свои первоначальные свойства.
Сплавы
Сплав — это смесь металлов. Один из наиболее распространенных примеров сплавов — сталь (смесь железа и углерода).
Сплавы относятся к однородным смесям.
Бронза — сплав меди с оловом и другими металлами
Коллоидные и истинные растворы
В коллоидном растворе очень маленькие частицы одного вещества равномерно распределяются в другом веществе. Истинный же раствор является однородной системой, в которой растворенное вещество содержится в виде молекул.
Томатный сок — это пример коллоидного раствора, т.е. смесь мельчайших частичек помидора в воде!
Туман — пример коллоидного раствора
Соляная кислота — истинный раствор хлороводорода в воде
В чем разница между коллоидным раствором и суспензией?
С течением времени частицы вещества коллоидного раствора не оседают, а продолжают либо плавать на поверхности, либо находиться во взвешенном состоянии.
Суспензии
Суспензией называется смесь жидкости и частиц твердого вещества, которые растворяются в этой жидкости не полностью. Поэтому суспензии относятся к неоднородным типам смесей. Наиболее типичные суспензии — краски, чистящие пасты, некоторые косметические средства, уличная грязь и т.д.
Цементный раствор — пример суспензии
Главное отличие суспензии от остальных смесей заключается в том, что с течением времени, если суспензию не подвергали никакому воздействию, частички твердого вещества оседают.
Поделиться ссылкой
Элементы, соединения и смеси. .. Как разобраться?
.. Как разобраться?
По мнению химиков, все вещества на нашей планете — это элементы, соединения или смеси. Что они собой представляют? Чем одни отличаются от других? Давай разбираться.
Элемент
Элемент — это вещество, которое состоит из одинаковых атомов и которое нельзя разложить на более простые вещества. В элементе все атомы одинаковы и содержат равное количество протонов. Все элементы делятся на металлы и неметаллы. Железо, водород, кислород, золото, серебро, медь, углерод — вот лишь несколько примеров элементов.
Соединение
Соединение — это вещество, в составе которого находятся атомы двух и более элементов, соединенные между собой химической связью. Это означает, что в результате соединения атомов друг с другом образуется абсолютно новое вещество. Например, вода — это соединение водорода и кислорода, т.е. соединив кислород с водородом, мы можем получить воду! Стекло — это соединение кислорода, кремния, кальция и натрия.
Интересная особенность соединений заключается в том, что их химические и физические свойства отличаются от свойств образующих их атомов. Например, поваренная соль образуется во время реакции натрия с хлором. Несмотря на то, что хлор — ядовитый газ, полученное соединение — поваренная соль — не обладает опасными свойствами хлора.
Например, поваренная соль образуется во время реакции натрия с хлором. Несмотря на то, что хлор — ядовитый газ, полученное соединение — поваренная соль — не обладает опасными свойствами хлора.
Калий + марганец + кислород = марганцовка
Обычная марганцовка известна очень давно. Это вещество в виде порошка или кристаллов темно-фиолетового цвета довольно широко используется в медицине (как антисептик), промышленности, пиротехнике, садоводстве (для протравливания семян и избавления домашних растений от вредителей) и быту (для проведения дезинфекции).
Сточки зрения химии марганцовка, или перманганат калия, считается химическим соединением, в состав ко-торого входят калий, марганец и кислород.
Смеси
Смеси — это вещества, в состав которых входят элементы или соединения, не вступившие в химические реакции друг с другом. Это означает, что компоненты смеси перемешаны между собой, но не связаны химической связью, и их легко можно разделить. Например, перемешав металлические кнопки с осколками стекла, мы получим смесь. Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
Молоко — это смесь воды с мельчайшими частицами молочного жира, белка, минералов, витаминов и особого молочного сахара — лактозы
А теперь давай посмотрим с точки зрения химии на тесто. Легко представить, что тесто — это тоже смесь, в состав которой входят различные «соединения»: мука, молоко, яйца, жиры, сахар и т.д.
Однако «смесью» тесто мы можем называть только до тех пор, пока оно не попало в духовку. Готовый пирог — это уже новое «соединение».
Чай с точки зрения химии
Обыкновенный чай, который ты пьешь, — это тоже пример смеси. И соотношение компонентов в ней может быть разным: кто-то любит покрепче и добавляет больше заварки, кто-то — послаще и кладет больше сахара, а кому-то нравится чай с лимоном или молоком. В каждом из этих случаев чай, или «смесь» с точки зрения химии, будет разным, несмотря на то что для его приготовления использовались одинаковые компонентов.
В каждом из этих случаев чай, или «смесь» с точки зрения химии, будет разным, несмотря на то что для его приготовления использовались одинаковые компонентов. Свойства смесей
Каждый компонент смеси сохраняет свои индивидуальные химические свойства, и все компоненты могут находиться в абсолютно любых пропорциях. Например, воздух, которым мы дышим, представляет собой смесь кислорода и других веществ, количество которых может меняться в зависимости от того места, где ты находишься. Согласись, что содержание пыли, копоти и прочих вредных веществ на оживленной загазованной улице мегаполиса будет гораздо выше, чем в лесу или парке.
Смеси могут быть твердыми, жидкими и газообразными. Например, воздух — это смесь газов, соленая вода — смесь жидкости и твердого вещества (соли), а бронза — твердая смесь (сплав меди и олова).
Основные отличительные признаки смесей:
- Все компоненты смеси можно разделить.
- Все компоненты сохраняют свои индивидуальные свойства.

Поделиться ссылкой
Чистое вещество и смеси. Химия
В 8-м классе школьники изучают в курсе химии чистые вещества и смеси. Наша статья поможет им разобраться в этой теме. Мы расскажем, какие вещества называют чистыми, а какие – смесями. А вы когда-нибудь задумывались над вопросом: «Существует ли абсолютно чистое вещество?» Возможно, ответ вас удивит.
Для чего эту тему изучают в школе?
Прежде чем рассматривать определение «чистого вещества», необходимо разобраться с вопросом: «С каким веществом мы на самом деле имеем дело – с чистым или смесью?»
Во все времена чистота вещества волновала не только научных сотрудников, ученых, но и простых людей. Что мы обычно вкладываем в это понятие? Каждый из нас хочет пить воду без примесей тяжелых металлов. Мы хотим дышать свежим воздухом, который не загрязнен выхлопными газами автомобилей. Но можно ли назвать незагрязненные воду и воздух чистыми веществами? С точки зрения науки – нет.
Что такое смесь?
Итак, смесь – это вещество, которое содержит молекулы нескольких видов. Теперь подумайте о составе воды, кторая течет из крана – да-да, в ней много примесей. В свою очередь вещества, которые составляют смесь, называются компонентами. Рассмотрим пример. Воздух, которым мы дышим, – это смесь разных газов. Компоненты, входящие в его состав – кислород, азот, углекислый газ и так далее. В случае, если масса одного компонента в десятки раз меньше массы другого, то такое вещество называют примесью. Часто в природе встречается воздух, который загрязнен примесями сероводорода. Этот газ имеет запах тухлых яиц и является ядовитым для человека. Когда отдыхающие на берегу реки разводят костер, то он загрязняет воздух углекислым газом, который тоже опасен в большом количестве.
У особо догадливых ребят, возможно, уже возник вопрос: «Что чаще встречается – чистые вещества или смеси?» Отвечаем на ваш вопрос: «В основном все, что нас окружает – это смеси».
Таким удивительным образом устроена природа.
Несколько слов о видах чистых веществ
В начале статьи мы обещали рассказать о том, существуют ли вещества абсолютно без примесей. Как вы думаете, бывают ли такие? О водопроводной воде мы уже говорили. Номожет ли содержать в себе примеси родниковая вода? Ответ на этот вопрос прост: абсолютно чистые вещества в природе не встречаются. Однако в научных кругах принято говорить об относительной чистоте вещества. Звучит это так: «Вещество чистое, но с оговоркой». Так, например, оно может быть чистым технически. Чернила черные и фиолетовые содержат примеси. Если их нельзя обнаружить при помощи химической реакции, то такое вещество называют химически чистым. Такой бывает дистиллированная вода.
О чистоте
Итак, пришло время поговорить о чистом веществе. Это такое вещество, которое в своем составе имеет частицы только одного вида. Оказывается, оно имеет особенные свойства. У него есть еще одно название: индивидуальное вещество. Давайте попробуем охарактеризовать свойства чистой воды:
- индивидуальное вещество: дистиллированная вода;
- температура кипения – 100°C;
- температура плавления – 0°C;
- такая вода не имеет вкуса, запаха и цвета.

Как разделять вещества?
Этот вопрос тоже уместен. Очень часто в быту и на производстве (в большей мере) человек разделяет вещества. Так, например, в молоке образуются сливки, которые можно собрать с поверхности, если применить метод отстаивания. Во время переработки нефти человек производит бензин, ракетное топливо, керосин, машинное масло и так далее. На всех этапах переработки человек применяет самые разные способы разделения смесей, которые зависят от агрегатного состояния вещества. Рассмотрим каждый из них.
Фильтрация
Данный метод применяют в том случае, когда есть жидкое вещество, в котором содержатся нерастворимые твердые частицы. Например, вода и речной песок. Такую смесь человек пропускает через фильтр. Таким образом, песок задерживается в фильтре, а чистая вода спокойно через него проходит. Мы редко придаем этому значение, но каждый день на кухне многие горожане пропускают воду из-под крана через очистительные фильтры. Так что в определенной степени вы можете считать себя учеными!
Отстаивание
Об этом методе мы сказали несколько слов чуть выше.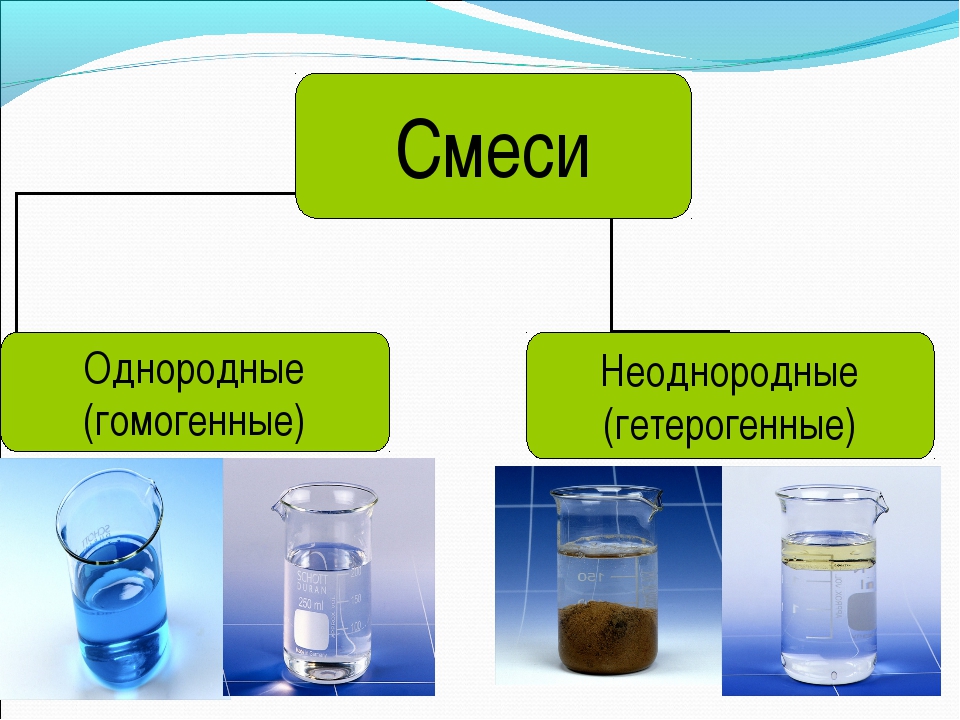 Однако рассмотрим его подробнее. К такому методу химики прибегают в случае, когда необходимо разделить суспензии или эмульсии. Например, если в чистую воду проникло растительное масло, то полученную смесь необходимо встряхнуть, затем дать ей настояться некоторое время. После этого человек будет наблюдать явление, когда масло в виде пленки покроет воду.
Однако рассмотрим его подробнее. К такому методу химики прибегают в случае, когда необходимо разделить суспензии или эмульсии. Например, если в чистую воду проникло растительное масло, то полученную смесь необходимо встряхнуть, затем дать ей настояться некоторое время. После этого человек будет наблюдать явление, когда масло в виде пленки покроет воду.
В лабораториях химики применяют еще один метод, который называется делительная воронка. При использовании этого способа очищения плотная жидкость проникает в емкость, а то, что легче – остается.
Метод отстаивания имеет серьезный недостаток – это низкая скорость протекания процесса. В этом случае необходимо длительное время для формирования осадка. На промышленных предприятиях такой способ все равно используют. Инженеры проектируют специальные конструкции, которые имеют название «отстойники».
Магнит
Каждый из нас хотя бы раз в жизни играл с магнитом. Его удивительное свойство притягивать металлы казалось магическим. Находчивые люди догадались применить магнит для того, чтобы разделять смеси. Например, разделение деревянных и железных опилок возможно при помощи магнита. Но стоит учесть, что не все металлы он может притягивать, ему подвластны только те смеси, в которых содержатся ферромагнетики. К ним можно отнести никель, тербий, кобальт, эрбий и так далее.
Находчивые люди догадались применить магнит для того, чтобы разделять смеси. Например, разделение деревянных и железных опилок возможно при помощи магнита. Но стоит учесть, что не все металлы он может притягивать, ему подвластны только те смеси, в которых содержатся ферромагнетики. К ним можно отнести никель, тербий, кобальт, эрбий и так далее.
Дистилляция
Этот термин имеет латинские корни, в переводе означает «стекание каплями». Такой метод представляет собой разделение смесей, основанное на разницах температуры кипения веществ. Именно этот способ поможет разделить воду и спирт. Последнее вещество испаряется при +78°C. Когда его пары касаются холодных стенок и поверхностей, пары конденсируются, превращаясь в жидкое вещество.
В тяжелой промышленности данным методом добывают продукты нефти, чистые металлы, а также разнообразные душистые вещества.
Можно ли разделить газы?
Мы с вами говорили про чистые вещества и смеси в жидком и твердом состоянии. А как быть, если необходимо провести разделение газовых смесей? Светлые головы химической промышленности сегодня практикуют несколько физических способов разделения газообразных смесей:
- конденсация;
- сорбирование;
- мембранное разделение;
- дефлегмация.

Итак, в нашей статье мы с вами рассмотрели понятие чистых веществ и смесей. Мы выяснили, что чаще встречается в природе. Теперь вы знаете различные способы разделения смесей – и некоторые из них можете продемонсттрировать самостоятельно, например магнит. Надеемся, что наша статья была для вас полезной. Изучайте науку сегодня, чтобы завтра она помогла вам решить любую проблему – как у себя дома, так и на производстве!
Чистые вещества: примеры. Получение чистых веществ
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко – это целый комплекс сложных химических веществ, которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное – это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим способы разделения смесей. А также взглянем на типичные примеры чистых веществ.
Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное – это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим способы разделения смесей. А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества – это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом – m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом – m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо чистые вещества (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.
Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества – рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества – рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ – смесям. Смесь – это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Содержат одно вещество | Включают в себя различные вещества |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в виде смесей. Они применяются в фармакологии, промышленном производстве.
Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят респираторные маски, защищающие их от отравления.
Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят респираторные маски, защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с гомогенными смесями, такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль.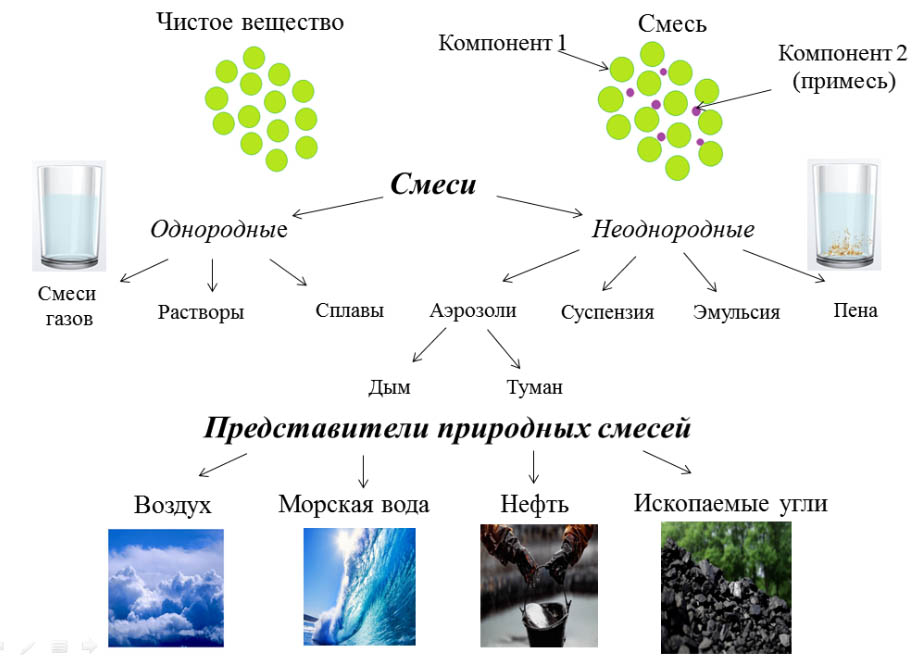 С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача — отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.
Хроматография
Последний метод отделения – хроматография.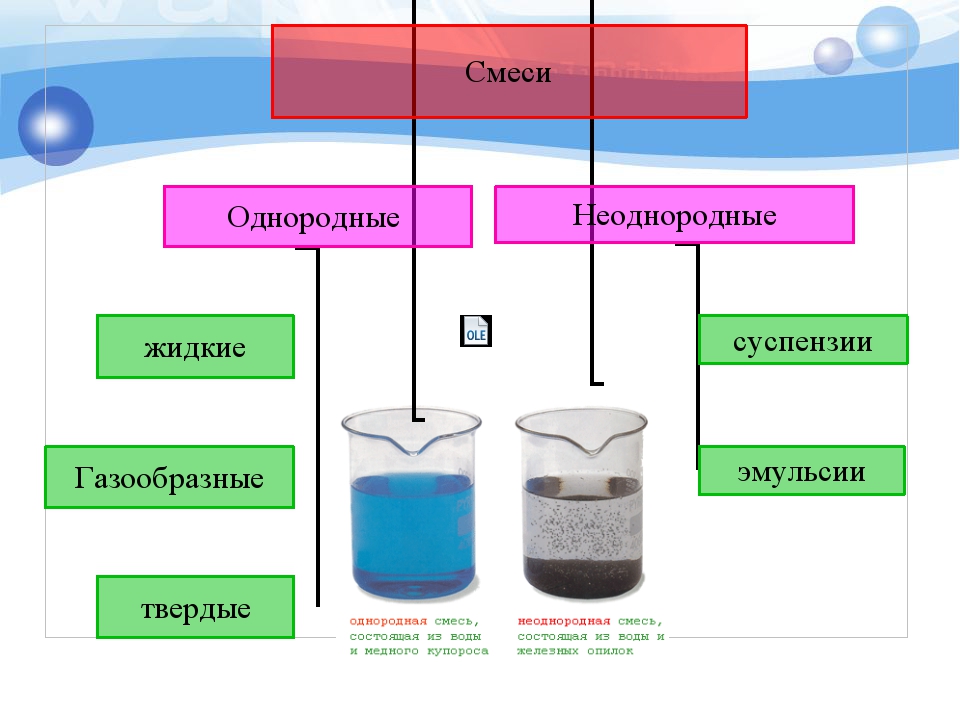 Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида. Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре \(0\) °С, кипит при температуре \(+100\) °С, при температуре \(+4\) °С имеет плотность \(1000\) кг/м³ и практически не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
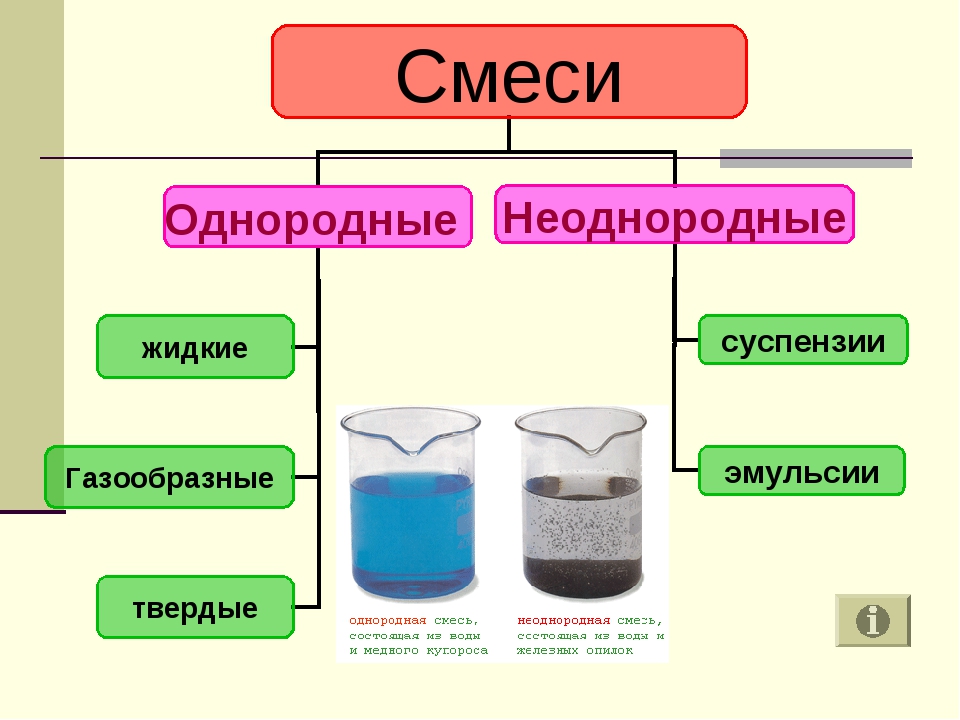
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Презентация к уроку по химии (11 класс) на тему: Чистые вещества и смеси.Состав смесей. Разделение смесей.
Слайд 1
Чистые вещества и смеси. Состав смесей. Разделение смесей. 11 баз классСлайд 2
Цели урока: Выяснить, какое вещество считают чистым. Что такое смесь? Какие бывают смеси? Какими способами можно разделить смеси?
Слайд 3
В природе нет практически чистых веществ
Слайд 5
Чистые вещества обладают постоянными физическими свойствами. Например: дистиллированная вода Вещества, не содержащие примесей других веществ
Например: дистиллированная вода Вещества, не содержащие примесей других веществ
Слайд 6
Смеси состоят из двух или более веществ, которые называют компонентами смеси.
Слайд 7
Смеси – это комбинация из нескольких веществ. Например : Воздух Молоко Сплавы металлов Растворы Дым Туман Бетон Чугун и другие
Слайд 9
СМЕСИ , с которыми вы встречаетесь в повседневной жизни: Сок из фруктов Молоко Кофе
Слайд 11
Агрегатное состояние однородных смесей : Смеси газообразные жидкие твердые воздух кофе монеты
Слайд 13
Примеры смесей Однородная смесь, состоящая из воды и медного купороса Неоднородная смесь, состоящая из воды и железных опилок
Слайд 14
Неоднородные смеси В неоднородных смесях невооруженным глазом или с помощью микроскопа моно различить частички вещества (поверхность раздела)
Слайд 15
Однородные смеси В однородных смесях частички веществ различить невозможно.
Слайд 16
Выводы: Чистое вещество имеет постоянный состав. Чистое вещество обладает постоянными физическими свойствами ( t кип , t плав , ρ и др.)
Чистое вещество обладает постоянными физическими свойствами ( t кип , t плав , ρ и др.)
Слайд 17
Способы разделения смесей
Слайд 18
Способы разделения неоднородных смесей Отстаивание: Выделение веществ из неоднородной смеси, образованной нерастворимыми в воде веществами с различной плотностью. В делительной воронке
Слайд 19
Способы разделения неоднородных смесей Фильтрование Выделение веществ из неоднородной смеси, образованной растворимыми и нерастворимыми в воде веществами.
Слайд 20
Способы разделения неоднородных смесей Действие магнитом
Слайд 21
Способы разделения однородных смесей Выпаривание Кристаллизация Дистилляция (или перегонка) Хроматография Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография.
Слайд 22
Способы разделения однородных смесей Выпаривание Чтобы растворенное вещество выделить из раствора, последний выпаривают. Вода испаряется, а в фарфоровой чашке остается соль
Слайд 23
Способы разделения однородных смесей
Слайд 24
Способы разделения однородных смесей Перегонка или дистилляция Этот способ основан на различии в температурах кипения друг в друге компонентов. Прием разделения однородных смесей путем испарения летучих жидкостей с последующей конденсацией их паров. Пример: получение дистиллированной воды.
Прием разделения однородных смесей путем испарения летучих жидкостей с последующей конденсацией их паров. Пример: получение дистиллированной воды.
Слайд 25
1. Смесью являются: Водопроводная вода Углекислый газ Медь
Слайд 26
2. Чистое вещество: Морская вода Молоко Кислород
Слайд 27
3. Смесью не является: Дистиллированная вода Воздух Почва
Слайд 28
4. Смесью является: Алюминий Азот Воздух
Слайд 29
Контрольное задание Из предлагаемого перечня укажите вещества и смеси: Вариант №1 Раствор мела , какао, железная стружка, столовый уксус, поваренная соль, графит. Вариант №2 сладкий чай, воздух, медь, алюминий, минеральная вода, сахар.
Слайд 30
Контрольное задание Укажите тип смеси: Вариант №1 Раствор поваренной соли Смесь порошков алюминия и железа Раствор уксуса Вариант №2 Смесь сахар и песок Минеральная вода Медный порошок и деревянные опилки
Слайд 31
Перед вами названия различных химических систем. Из перечисленных систем выберите чистые вещества. Дистиллированная вода Морская вода Кислород Серебро Гранит Водка Сталь Раствор хлорида натрия для инъекций Водород Чугун Углекислый газ Воздух Базальт Стекло Эмульсия «масло в воде» Свинец
Дистиллированная вода Морская вода Кислород Серебро Гранит Водка Сталь Раствор хлорида натрия для инъекций Водород Чугун Углекислый газ Воздух Базальт Стекло Эмульсия «масло в воде» Свинец
Слайд 32
Чистые вещества Дистиллированная вода Кислород Серебро Водород Углекислый газ Свинец
Слайд 33
Истинные растворы Водка Раствор хлорида натрия для инъекций
Слайд 34
Смеси Морская вода Гранит Водка Сталь Раствор хлорида натрия для инъекций Чугун Воздух Базальт Стекло Эмульсия «масло в воде»
Слайд 35
Источники ХиМуЛя https :// sites.google.com/site/himulacom/zvonok-na-urok/8-klass
Слайд 36
Автор: Калитина Тамара Михайловна Место работы: МБОУ СОШ №2 с.Александров-Гай Саратовской области Должность: учитель химии. Дополнительные сведения: сайт http://kalitina.okis.ru/ Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna
Химия: Разделение смесей
- Обзор
- Мир
- Обзор мира
- Атлас
- Страны
- Бедствия
- Новости
- Флаги мира
- География
- Международные отношения
- Религия
- Статистика
- Строения и здания
- Путешествия
- Мировые правители
- Люди
- Обзор людей
- Академия и культура
- Искусство и развлечения
- Бизнес
- Правительство
- Ньюсмейкеры
- Наука
- Спорт
- U.
 S.
S. - Обзор США
- Города
- Документы США
- Гендерные вопросы
- География
- Правительство
- Новости
- Военные
- Памятники и достопримечательности
- Почтовая информация
- Раса и этническая принадлежность
- Штаты
- Мир
Энергетические изменения в химических реакциях | Глава 6: Химические изменения
youtube.com/embed/8k_csPv9pDo» frameborder=»0″ allowfullscreen=»»> >
Ключевые концепции
- Если два вещества вступают в реакцию и температура смеси понижается, реакция эндотермическая.
- Если два вещества вступают в реакцию и температура смеси увеличивается, реакция экзотермическая.
- Химическая реакция включает разрыв связей в реагентах и образование связей в продуктах.
- Для разрыва связей требуется энергия.
- Энергия высвобождается при образовании связей.
- Если реакция эндотермическая, для разрыва связей реагентов требуется больше энергии, чем выделяется при образовании связей продуктов.
- Если реакция является экзотермической, при образовании связей продуктов выделяется больше энергии, чем требуется для разрыва связей реагентов.
Сводка
Студенты проведут две химические реакции. В первом случае температура будет понижаться (эндотермическая), а во втором — повышаться (экзотермическая).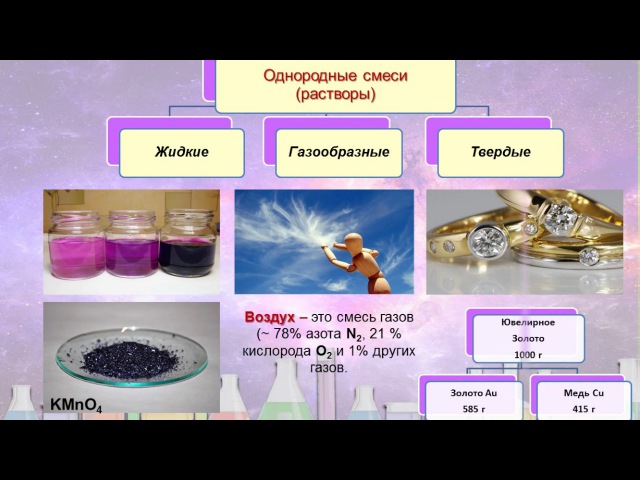 Учащиеся увидят анимационный ролик, в котором рассматривается концепция, представленная в главе 5, — что для разрыва связей требуется энергия, и эта энергия высвобождается при образовании новых связей.Студенты будут использовать эту идею, чтобы объяснить, почему реакция является эндотермической или экзотермической.
Учащиеся увидят анимационный ролик, в котором рассматривается концепция, представленная в главе 5, — что для разрыва связей требуется энергия, и эта энергия высвобождается при образовании новых связей.Студенты будут использовать эту идею, чтобы объяснить, почему реакция является эндотермической или экзотермической.
Цель
Студенты смогут определять эндотермическую и экзотермическую реакцию. Учащиеся смогут использовать понятие энергии при разрыве и образовании связей, чтобы объяснить, почему одна реакция может быть эндотермической, а другая — экзотермической.
Оценка
Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении.Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ученики носите правильно подогнанные очки.
материалов для каждой группы
- Уксус
- Сода пищевая
- Хлорид кальция
- Вода
- Термометр
- 4 маленьких чашки
- Одноразовый самонагреватель для рук
- Баллон самонадувающийся
Дополнительные материалы, если вы выберете дополнительное расширение
- Сульфат магния
- Карбонат натрия
- Лимонная кислота
- Универсальный индикатор
О материалах
Хлорид кальция можно приобрести у Sargent Welch, продукт № WLC94075-06, или у Flinn Scientific, продукт № C0016, или у других поставщиков. Хлорид кальция также доступен в хозяйственных магазинах для поглощения влаги и таяния льда зимой.
Хлорид кальция также доступен в хозяйственных магазинах для поглощения влаги и таяния льда зимой.
Грелки для рук можно приобрести в Flinn Scientific, каталог № AP1931, а также в магазинах товаров для кемпинга, спортивных товаров или уцененных товаров. Ищите грелки для рук, которые являются одноразовыми и запечатаны в упаковке и будут нагреваться только при открытии упаковки. Самонадувающиеся майларовые воздушные шары можно приобрести в Joissu, товарный номер № 43-712, или в компании «Образовательные инновации», товар № AS-800.
Смешайте! Химия смесей и разделения
Рози Коутс
Смеси повсюду вокруг нас, от стакана молока до чернил в ручке и ведра с песчаной водой на пляже.Часто мы рады, что они остаются такими, но иногда нам нужно разделить их и заполучить одну из частей в чистом виде. В этом блоге описываются некоторые химические процессы, используемые для разделения смесей, как низкотехнологичные идеи помогают перерабатывать высокотехнологичные отходы, а также действия, которые можно попробовать в уроках для ключевого этапа 3 и 4.
Песок, соли, водно-прибрежные смеси (Фото: Росс CC-BY-SA)
Возьмите ведро с морской водой…
Чтобы разделить два вещества, должно быть различие в одном из их свойств .Соль растворима в воде, а песок — нет. Чтобы отделить песок от нашего ведра с морской водой, мы используем фильтрацию . Вода кипит при температуре около 100 градусов по Цельсию, соль — нет. Чтобы отделить воду и соль от остатков нашего ведра, мы используем дистилляцию (выпаривание воды и ее конденсация в другой емкости). Если в воде есть масло, мы можем воспользоваться разницей плотности , чтобы разделить масло и воду с помощью делительной воронки. В результате у нас остается песок, соль, масло и вода, которые можно пить; удобно знать, если вы оказались на необитаемом острове!
Вы можете найти множество занятий по различным темам на страницах Learn-Chemistry Королевского химического общества, в том числе эту, посвященную смесям и разделению.
Разделение полезно не только в лаборатории: от горнодобывающей промышленности до вторичной переработки используются различные методы разделения.
Переработка грязных смесей
Recycling полагается на возможность отсортировать различные материалы, чтобы их можно было преобразовать в новые объекты.Вы можете провести подобную сортировку у себя дома, возможно, вам придется отделять стекло от пластика в своей коллекции для вторичной переработки.
Отделить пластик от стеклянных бутылок? (Фото: CC-BY-SA)
В процессе переработки могут использоваться различные методы. Магнитные материалы, такие как сталь, можно разделять с помощью магнитов, различные пластмассы можно разделять в зависимости от их плотности. Часто это делается с использованием крайне низкотехнологичного оборудования.
Попробуйте сами
Вы можете попробовать разделить различные пластмассы самостоятельно по плотности.
1. Измельчите различные пластмассы и поместите их в небольшой кувшин с водой. Некоторые будут плавать, а некоторые тонуть.
Некоторые будут плавать, а некоторые тонуть.
2. Выньте плавающие части.
3. Теперь добавляйте немного соли в воду, пока некоторые из утонувших кусков не начнут всплывать.
4. Зачерпните их.
5. Продолжайте, пока не получите разные груды пластика, отсортированные по плотности.
Добавление соли в воду увеличивает плотность воды, а это означает, что более плотные пластмассы могут плавать в ней.
От многовекового майнинга до микросхем
Дэвид Райт, главный пробирный на руднике Дживор, показывает семейной группе встряхивающие столы (Фото: Geevor Learning — Все права защищены)
С 18 века Корнуолл был известен своими оловянными рудниками. Олово было найдено вместе с медью, золотом и множеством других минералов. Один из способов сортировки различных материалов заключался в использовании встряхивающих столов , или отсадочных устройств . Наклонные столы (см. Фото выше) встряхивают, и воду используют для разделения материала на более плотный в нижней части стола и менее плотный в верхней части. Однако шахта Дживор использовала их не только для отделения материалов из шахт. В 1990 году столы использовались для утилизации печатных плат. Они были измельчены, и встряхивающие столы использовали для извлечения 95% меди. Довольно впечатляющий материал! Процесс работает до тех пор, пока один материал как минимум в три раза плотнее другого.
Однако шахта Дживор использовала их не только для отделения материалов из шахт. В 1990 году столы использовались для утилизации печатных плат. Они были измельчены, и встряхивающие столы использовали для извлечения 95% меди. Довольно впечатляющий материал! Процесс работает до тех пор, пока один материал как минимум в три раза плотнее другого.
ЦП, снятые с производства (Фото: Ондрей Мартин Мах CC-BY-SA)
Дживор закрылся как рудник в 1991 году, но он все еще жив и здоров как музей и учебный центр.Там команда разработала простые демонстрации пенной флотации, тяжелой среды и магнитной сепарации, чтобы посетители могли сами узнать, как работают эти методы разделения. Они являются настоящей площадкой для практических занятий, поэтому, если у вас есть возможность (возможно, вы посещаете Корнуолл летом) или находитесь в этом районе, их стоит посетить, либо посетите их веб-сайт, чтобы узнать больше об истории и науке добыча.
Школьная группа, использующая панорамирование для разделения материалов на руднике Дживор (Фото: Geevor Learning — Все права защищены)
Будь то в химической лаборатории при идентификации и очистке новых лекарств или при переработке и повторном использовании материалов из высокотехнологичных отраслей, понимание и способность использовать методы разделения неоценимы для нашей промышленности и окружающей среды, и, как вы можете видеть из приведенных выше детей, это может быть очень увлекательным!
Ссылки на учебные программы
Англия
Чистое и нечистое вещество
- Смеси
- Простые методы разделения смесей
Уэльс
Устойчивая Земля
- Физические и химические свойства некоторых элементов, соединений и смесей и способы разделения смесей простыми методами
Шотландия
Материалы — свойства и использование веществ
- Я могу различать чистые вещества и смеси, которые обычно используются, и могу выбрать соответствующие физические методы для разделения смесей на их компоненты.

SCN 3-16a
Северная Ирландия
Химическое и материальное поведение
- Элементы, соединения и смеси
У нас есть широкий выбор инженерных шоу для начальной, средней и семейной аудитории.
Мы также работаем в партнерстве с Tomorrow’s Engineers, чтобы вдохновлять новое поколение инженеров!
______________________________________________________________________
Мы — science made simple — общественная организация, которая продвигает науку, математику и инженерное дело в школах и среди населения.Вы можете узнать больше о том, чем мы занимаемся, заказать нас вживую с одним из наших захватывающих шоу или подписаться на нашу рассылку и узнать, чем мы занимаемся!20 Примеры гетерогенных смесей ~ LORECENTRAL
В химии смесь относится к объединению по меньшей мере двух веществ в различных пропорциях без химического соединения. Это означает, что каждое из веществ, входящих в состав смесей, вносит свой вклад в общее целое.
Это означает, что каждое из веществ, входящих в состав смесей, вносит свой вклад в общее целое.
Внутри смесей можно выделить два варианта, а именно:
- Гомогенные смеси: В смесях этого типа очень трудно определить, какие элементы составляют их. Таким образом, человек может обнаружить только одну физическую фазу. В однородных жидких веществах, называемых «растворами», идентифицируются растворители растворенных веществ.Хотя растворенные вещества малы и почти всегда жидкие, в пропорции преобладают растворители. Например, вино, пиво, желатин, вода и алкоголь.
- Гетерогенные смеси: В отличие от гомогенных смесей, в них очень легко определить, даже невооруженным глазом, какие компоненты входят в их состав. Это значительно упрощает разделение этих смесей. Например, вода и масло, вода и песок.
Примеры гетерогенных смесей
Салат-латук и томатный салат. | Вода и песок |
| Вода и масло. | Гелий и воздух. |
| Воздух и земля. | Суп с лапшой |
| Рис и фасоль. | Вода и сахар |
| Уксус и масло. | Сосиски с майонезом. |
| Вода и нафта. | Картофель и яйцо. |
| Камни и дерево. | Вода и камни. |
| Бумага и ленты | Молоко с зефиром. |
| Вода и парафин | Печенье со сладким маслом. |
| Картофель фри и арахис. | Дерево и камень |
Методы разделения смесей
Со временем были разработаны различные методы разделения компонентов, составляющих смеси.
Вот некоторые из них:
- Просеивание : Используется для твердых смесей в виде зерен. Затем их пропускают через одно или несколько сит, если это необходимо.Таким образом, пока один элемент остается в сите, остальные падают.

- Магнитное разделение (или намагниченность ): Этот метод очень ограничен, поскольку он может применяться только в тех смесях, в которых некоторые из его компонентов обладают магнитными свойствами. Затем они захватываются каким-то магнитом.
- Фильтрация : Если вы хотите разделить смеси, содержащие нерастворимые твердые вещества и жидкости, вы можете выбрать этот вариант, который состоит из использования воронки из фильтровальной бумаги внутри.Таким образом, элементы, которые проходят через воронку, будут отделены от тех, которые в ней удерживаются.
- Кристаллизация и осаждение : В этом методе температура смеси повышается, и, таким образом, ее можно сконцентрировать, затем отфильтровать и поместить в кристаллизатор, где ей дают отдохнуть, пока жидкость не испарится. Как только это происходит, твердая часть сохраняется в кристаллизаторе в виде кристаллов. Как было замечено, это подходящий метод для разделения смесей, состоящих из твердого вещества, растворенного в растворителе.



 .. Как разобраться?
.. Как разобраться?



 S.
S.  Некоторые будут плавать, а некоторые тонуть.
Некоторые будут плавать, а некоторые тонуть.