Свойства веществ и смесей — Справочник химика 21
Сложная многокомпонентная смесь неуглеводородных компонентов нефти была разделена на несколько фракций более или менее однородных но составу и свойствам веществ. Это несколько упрощало изучение их строения. К середине нашего столетия были разработаны и испытаны новые физические методы, позволяющие решать ряд структурно-молекулярных вопросов, касающихся сложных органических веществ. Удачно подобранный комплекс таких методов позволил приступить непосредственно к изучению строения молекул нефтяных асфальтенов. Корреляция полученных данных с прямыми химическими исследованиями делает особенно достоверными сведения о химическом строении молекул нефтяных [c.91]Определив свойства неизвестного вещества, можно отождествить его с одним из известных веществ, т. е. опознать, определить неизвестное вещество. Для такого качественного анализа достаточно исследовать несколько характерных аналитических свойств данного вещества или продуктов некоторых его реакций.

Выбор способа сушки и осушителя зависит от свойств вещества. В ряде случаев маточные растворы после кристаллизации частично упаривают, получая дополнительное количество веш,еств. Если же исходная смесь содержит соизмеримое количество разделяемых веществ, для получения хороших результатов процесс перекристаллизации повторяют несколько раз. [c.33]
Система называется гомогенной, если она одинакова по составу, структуре и, следовательно, по свойствам во всех своих микроучастках. В этом случае можно сказать, что система состоит из одной фазы (истинный раствор вещества, смесь газов и т. п.). [c.100]
В этом случае можно сказать, что система состоит из одной фазы (истинный раствор вещества, смесь газов и т. п.). [c.100]
Многочисленные методы разделения газовых смесей, применяемые в технике [3, 43], основаны на использовании тех или иных отличий в свойствах веществ, входящих в смесь, [c.227]
Для мытья посуды употребляют различные растворители, подбирая их в соответствии с видом загрязнений. Вещества основного характера отмывают разбавленными или концентрированными минеральными кислотами, вещества кислотного характера—растворами соды или щелочи. Для растворения органических веществ применяют спирты, ацетон, бензол, бензин, эфиры и т. д. Остатки после перегонки лучше всего растворять в предгонах, Осмоленные остатки после реакции отмывают нагреванием с хромовой смесью, причем сосуд сначала ополаскивают водой, затем оставляют на некоторое время с хромовой смесью и, нако нец, нагревают. Хромовую смесь готовят, растворяя 5 г бихромата натрия или калия в 5 мл воды и постепенно прибавляя к этому раствору 100 мл концентрированной серной кислоты или растворяя 5 г бихромата натрия в 100 мл концентрированной серной кислоты, нагретой до 100°.
Наиболее универсальным методом современной химии, применяемым как в лабораторных, так и в промышленных анализах, является хроматография. Можно смело сказать, что современная химическая наука и технология переживает хроматографическую эру . Честь открытия этого универсального метода принадлежит русскому ботанику М. С. Цвету, который в 1903 г. обнаружил, что при пропускании через колонку, заполненную адсорбентом раствора смеси окрашенных веществ — пигментов зеленого листа — это смесь разделяется на отдельные зоны по длине колонки, причем в каждой зоне находится либо индивидуальное соединение, либо смесь двух-трех практически не различающихся по свойствам веществ. [c.119]
Свойства веществ составивших механическую смесь — сохраняются вступив ших в химическую реакцию — не сохраняются [c. 4]
4]
ГИХ веществ несколько иное. Это обусловлено некоторыми физическими свойствами вещества, главным образом степенью ассоциации молекул в жидкости и характером изменения ее в зависимости от давления. Именно поэтому перегонкой в вакууме часто удается легче разделить смесь близко кипящих веществ, чем при атмосферном давлении.
Индивидуальные свойства веществ, составляющих механическую смесь, сохраняются, так как составные части в смеси находятся химически неизмененными. При химических реакциях свойства исходных веществ не сохраняются, поскольку в результате их взаимодействия образуются новые вещества с новыми свойствами. [c.58]
Необходимым условием применения этого метода является регистрация всех компонентов пробы и одинаковая чувствительность детектора к разным веществам. Для большинства детекторов это, в общем, справедливо, если анализируется смесь родственных соединений, молекулярные массы которых значительно не различаются или все компоненты пробы имеют большие молекулярные массы. Например, не требуется калибровка при анализе смеси циклогексана и бензола или при анализе изомеров ксилола. Этот вариант метода имеет ограниченное применение. В большинстве случаев приходится учитывать разный отклик детектора к различным веществам пробы с помощью калибровочных коэффициентов, зависящих от свойств вещества, способа детектирования, а также от конструкции детектора. [c.114]
Например, не требуется калибровка при анализе смеси циклогексана и бензола или при анализе изомеров ксилола. Этот вариант метода имеет ограниченное применение. В большинстве случаев приходится учитывать разный отклик детектора к различным веществам пробы с помощью калибровочных коэффициентов, зависящих от свойств вещества, способа детектирования, а также от конструкции детектора. [c.114]
Органические растворители широко применяются в лабораториях органической химии при проведении синтезов, при очистке продуктов реакции и при изучении физических свойств веществ. В зависимости от назначения растворителя требования к его чистоте различны. В качестве растворителей могут быть использованы индивидуальные вещества или смесь веществ (бензин, петролейный эфир и др.). Растворители без примеси воды, как было указано выше, называются абсолютными (абсолютный спирт, абсолютный эфир). Ниже рассмотрены свойства, способы очистки и абсолютирования некоторых растворителей.  69]
69]
Свойства веществ, составляющих смесь, сохраняются. Это является результатом того, что составные части в смеси существуют в химически неизмененном виде. При химической же реакции свойства исходных веществ резко изменяются, так 1 ак в результате их соединения образуется новое вещество с новыми свойствами. [c.14]
Применение. Показатель преломления—важная физическая константа, которой следует пользоваться в сочетании с точками плавления и кипения, плотностью и другими свойствами при качественной идентификации органических жидкостей. На рис. 253—257 воспроизводится ряд диаграмм, которые иллюстрируют значение корреляции двух физических свойств для облегчения идентификации анализируемых веществ. Нанесением показателя преломления в зависимости от плотности для большого числа чистых соединений найдено, что диаграммы можно разделить на зоны или области (см. рис. 253), которые включают определенные классы соединений. Зоны могут перекрываться, поэтому требуется проведение дополнительного испытания с целью распознавания исследуемого вещества для этого можно использовать другое физическое свойство, например температуру кипения, или провести химическое испытание.
Таким образом, улэкспериментальный материал о строении и свойствах веществ, но выработались и такие важные научные понятия, как химический элемент , сложное и простое вещество, химическое соединение и механическая смесь и т. д. В практике химии утверждается точный количественный подход к изучению всех процессов. При объяснении последних химия получила возможность опираться на некоторые уже установленные законы и теории, позволявшие давать этим процессам правильное материалистическое объяснение. В [c.292]
В [c.292]
Свойства. Водород — бесцветный газ, без вкуса и запаха, т. пл. —259 °С, т. кип. —253°С. Меньше, чем другие газы, он растворим в воде (0,02 об. ч. Нг на 1 об. ч. НгО при 0°С). Плотность твердого водорода равна 0,08 г/см , это самое легкое твердое вещество. Смесь водорода с кислородом (гремучий газ), весьма опасна, при поджигании она взрывает с большой силой. [c.463]
Разделение смеси различных веществ на компоненты. При исследовании липидов в некоторых случаях необходимо сложную смесь различных по свойствам веществ разделять на более узкие группы или получать концентраты с повышенным содержанием исследуемых соединений. Для этих целей может быть применены ректификация и фракционирование кристаллизацией из растворов. [c.282]
Подчеркнем еще раз, что конформации легко переходят друг в друга и поэтому не могут быть выделены в индивидуальном состоянии в виде устойчивых изомеров. Большая часть органических веществ представляет собой смесь конформаций, находящихся в равновесии. Среди последних преобладают наиболее выгодные, обладающие минимальной внутренней энергией. Многие физические и химические свойства веществ зависят от того, какая именно конформация окажется у них преобладающей.
Среди последних преобладают наиболее выгодные, обладающие минимальной внутренней энергией. Многие физические и химические свойства веществ зависят от того, какая именно конформация окажется у них преобладающей.
Если в момент времени t=0 в точке х=х ввести в такую систему смесь веществ, компоненты которой могут находиться в обеих фазах, то в результате динамического обмена между фазами каждый компонент распределяется между ними в отношении, зависящем от химических свойств вещества. За то время, пока молекулы вещества находятся в подвижной фазе, она переносит их в следующий участок неподвижной фазы, где они снова вступают с ней во взаимодействие. Если компоненты в достаточной степени различаются по своим химическим свойствам, то в процессе осуществления множества таких последовательных стадий они разделяются в объеме системы и выходят из нее один за другим вместе с подвижной фазой. [c.10]
Хальденвангер [194] наиболее полно сформулировал требования, предъявляемые к эталонным смесям 1) по свойствам эталонная смесь должна приближаться к идеальному раствору, т. е. практически без отклонений подчиняться закону Рауля и иметь относительную летучесть компонентов, постоянную для всех концентраций 2) данные по равновесию пар— жидкость должны быть известны или их можно легко рассчитать 3) смесь должна состоять только из двух компонентов во избежание трудностей при измерениях и расчетах 4) относительная летучесть компонентов должна иметь такое значение, чтобы в испытуемой колонне достигалось достаточное, но не слишком большое разделение 5) температуры кипения смеси должны лежать в интервале, для которого нетрудно подобрать надежную тепловую изоляцию колонны 6) компоненты смеси должны быть термически стойкими в условиях ректификации 7) вещества и их смеси не должны вызывать коррозии конструкционных материалов, использованных в аппаратуре 8) исходные вещества должны быть легко доступными 9) вещества не должны содержать примесей их чистота должна поддаваться проверке доступными методами 10) смеси с любой концентрацией компонентов должны легко поддаваться анализу.
е. практически без отклонений подчиняться закону Рауля и иметь относительную летучесть компонентов, постоянную для всех концентраций 2) данные по равновесию пар— жидкость должны быть известны или их можно легко рассчитать 3) смесь должна состоять только из двух компонентов во избежание трудностей при измерениях и расчетах 4) относительная летучесть компонентов должна иметь такое значение, чтобы в испытуемой колонне достигалось достаточное, но не слишком большое разделение 5) температуры кипения смеси должны лежать в интервале, для которого нетрудно подобрать надежную тепловую изоляцию колонны 6) компоненты смеси должны быть термически стойкими в условиях ректификации 7) вещества и их смеси не должны вызывать коррозии конструкционных материалов, использованных в аппаратуре 8) исходные вещества должны быть легко доступными 9) вещества не должны содержать примесей их чистота должна поддаваться проверке доступными методами 10) смеси с любой концентрацией компонентов должны легко поддаваться анализу. [c.140]
[c.140]
Для охлаждения растворов и перекристаллизации ниже 0°С пользуются различными охлаждающими смесями. Наиболее распространенными из них являются смеси, содержащие снег или толченый лед в сочетании с различными веществами. Так, смесь, состоящая из 3 частей снега и 1 части Na l понижает температуру до — 21 °С. Приблизительно такими же свойствами обладает смесь из равных частей снега и Nh5NO3. Смесь 1,5 частей СаС -бИгО с 1 частью снега может дать температуру — 55°С. Смешиванием сухого льда с диэтиловым эфиром или ацетоном может быть достигнута температура — 78 °С. [c.33]
Определение растворимости. Растворимость вещества в различных растворителях помогает сделать заключение о наличии в веществе тех или иных функциональных групп. Кроме того, определение растворимости позволяет подобрать подходящий растворитель для перекристаллизации вещества ( подобное растворяется в подобном ). Растворимость целесообразно исследовать в следующих растворителях вода 5%-ные растворы едкого натра, гидрокарбоиата натрия, соляной кислоты концентрированная серная кислота этиловый спирт бензол петролейный эфир уксусная кислота. В пробирку вносят каплю жидкого или 0,01 г твердого соединения и по каплям 0,2 мл растворителя. После каждой прибавленной порции растворителя смесь взбалтывают. Если соединение полностью растворимо, то его регистрируют как растворимое. Если вещество плохо растворяется или не растворяется при комнатной температуре, нагревают до кипения. В случае плохой растворимости в неорганических растворителях нерастворившееся вещество отделяют, а раствор нейтрализуют и наблюдают, не выделяется ли из него исходное соединение. Помутнение нейтрализуемого фильтрата указывает на свойства вещества кислые — если растворителем была щелочь или сода основные — кислый растворитель. При внесении вещества в раствор гидрокарбоната нужно обратить внимание, не выделяется ли двуокись углерода. [c.122]
В пробирку вносят каплю жидкого или 0,01 г твердого соединения и по каплям 0,2 мл растворителя. После каждой прибавленной порции растворителя смесь взбалтывают. Если соединение полностью растворимо, то его регистрируют как растворимое. Если вещество плохо растворяется или не растворяется при комнатной температуре, нагревают до кипения. В случае плохой растворимости в неорганических растворителях нерастворившееся вещество отделяют, а раствор нейтрализуют и наблюдают, не выделяется ли из него исходное соединение. Помутнение нейтрализуемого фильтрата указывает на свойства вещества кислые — если растворителем была щелочь или сода основные — кислый растворитель. При внесении вещества в раствор гидрокарбоната нужно обратить внимание, не выделяется ли двуокись углерода. [c.122]
Можно считать, что если при соприкосновении двух или нескольких веществ не происходит их химического превращения, то такая система мо>1 ет называться механической смесью. Понятно, что свойства веществ, составляющих механическую смесь, сохраняются неизменными. Вещества, составляющие смесь, могут быть сме-щаны в любых количественных соотношениях. Компоненты смеси могут быть разделены иа основании их физических свойств. При смеи1ивании веществ не происходит выделегшя или иоглощегтя тепла в отличие от химических реакций (см. подробнее о тепловых эффектах химических реакций 1, гл. V). [c.121]
Вещества, составляющие смесь, могут быть сме-щаны в любых количественных соотношениях. Компоненты смеси могут быть разделены иа основании их физических свойств. При смеи1ивании веществ не происходит выделегшя или иоглощегтя тепла в отличие от химических реакций (см. подробнее о тепловых эффектах химических реакций 1, гл. V). [c.121]
Учение о флогистоне, направив внимание химиков на изучение процессов горения, окисления и восстановления веществ, привело А. Лавуазье к количественным исследованиям этих процессов, которые показали, что для их объяснеция флогистон излишен. К концу XVIII в. химия уже приобрела положение самостоятельной пауки, изучающей состав и свойства веществ. Оформление химии в науку произошло в результате четкого определепия предмета и задач данной науки, разработки количественного метода исследования, установления ряда основных понятий (химический элемент, соединение, смесь, химическая реакция) и открытия основополагающих законов (закон сохранения массы, стехиометрические законы). [c.8]
[c.8]
Понятие о твердой фазе. Термодинамическое определение фазы (см. гл. II, 9) включает следующие основные положения. Во-первых, подразумевается, что система находится в состоянии термодинамического равновесия, т. е. обеспечены условия свободного массопереноса и теплообмена как в объеме каждой фазы, так и в системе в целом. Во-вторых, каждая фаза, составляющая систему, должна быть физически однородной ее частью. При этом химическая однородность фазы не обязательна. Примером физически однородной (однофазной), но химически неоднородной системы являются воздух — молекулярный раствор газов, не взаимодействующих друг с другом, молекулярные водные растворы неэлектролитов и т. п. Химическая неоднородность в однофазной системе наблюдается только при полном отсутствии химического взаимодействия между компонентами. Если такое взаимодействие при образовании фазы возможно, то оно приводит к возникновению и физически и химически однородной однофазной системы. Например, смесь газообразного оксида азота и кислорода физически однородна. Если бы эти газы пе взаимодействовали друг с другом, то их смесь была бы однофазной, но химически неоднородной (как воздух). Поскольку в системе возмолхимическое взаимодействие, приводящее к образованию нового вещества (дыокспд азота НОг), то состояние термодинамического равновесия наступит тогда, когда система станет и физически и химически однородной. В-третьих, термодинамическое определение фазы предусматривает наличие межфазной границы раздела — поверхности, отделяющей данную фазу от всех остальных фаз в системе н от окружающего пространства. Поверхностный слой фазы находится в иных условиях по сравнению с объемом и обладает избыточной свободной энергией. Вследствие этого свойства поверхности отличаются от свойств вещества в целом. Поэтому понятие фазы применимо к макроскопическим объектам, для которых объемные свойства являются определяющими. Если поверхностными свойствами по сравнению с объемными пренебречь нельзя (что наблюдается, например, в тонких пленках), то классическое понятие фазы становится неприменимым.
Если бы эти газы пе взаимодействовали друг с другом, то их смесь была бы однофазной, но химически неоднородной (как воздух). Поскольку в системе возмолхимическое взаимодействие, приводящее к образованию нового вещества (дыокспд азота НОг), то состояние термодинамического равновесия наступит тогда, когда система станет и физически и химически однородной. В-третьих, термодинамическое определение фазы предусматривает наличие межфазной границы раздела — поверхности, отделяющей данную фазу от всех остальных фаз в системе н от окружающего пространства. Поверхностный слой фазы находится в иных условиях по сравнению с объемом и обладает избыточной свободной энергией. Вследствие этого свойства поверхности отличаются от свойств вещества в целом. Поэтому понятие фазы применимо к макроскопическим объектам, для которых объемные свойства являются определяющими. Если поверхностными свойствами по сравнению с объемными пренебречь нельзя (что наблюдается, например, в тонких пленках), то классическое понятие фазы становится неприменимым. При этом не имеет значения абсолютное количество вещества в объеме данной фазы, важ[ю лишь соотношение между поверхностью и объемом. Например, фазой нельзя считать тонкую масляную пленку на поверхности воды, хотя общая масса этой пленки может быть значительной. [c.302]
При этом не имеет значения абсолютное количество вещества в объеме данной фазы, важ[ю лишь соотношение между поверхностью и объемом. Например, фазой нельзя считать тонкую масляную пленку на поверхности воды, хотя общая масса этой пленки может быть значительной. [c.302]
Хикмен [93] и Эмбре [95] ввели для молекулярной дистил ляции понятие дистилляционная способность , т. е. отношение числа молекул вещества А, покидающих в единицу времени пи верхность испарения, к числу молекул вещества А, которые при тех же условиях остаются в пленке. Многократной циклической разгонкой можно полностью получить вещество А в виде дистиллата. Продолжительность дистилляции молшо сократить за счег повышения температуры испарения. Для определения KpnBoii выделения поступают следующим образом. Смесь перегоняют при постоянном вакууме и при постоянном подъеме температуры (например, повышая каждый раз температуру на 10°) и опреде ляют концентрацию дистиллата. Типичные кривые выделения приведены на рис. 215. Концентрация вначале растет до макси мума, затем падает до нулевого значения. Ход кривой, конечно зависит от свойства веществ и прежде всего от теплоты испаре ния, а также от продолжительности дистилляции, которая с цельк сравнения должна быть постоянной. Максимум кривой выделения соответствует температуре кипения при обычной дистилляции При увеличении времени дистилляции кривая выделения сме [c.318]
215. Концентрация вначале растет до макси мума, затем падает до нулевого значения. Ход кривой, конечно зависит от свойства веществ и прежде всего от теплоты испаре ния, а также от продолжительности дистилляции, которая с цельк сравнения должна быть постоянной. Максимум кривой выделения соответствует температуре кипения при обычной дистилляции При увеличении времени дистилляции кривая выделения сме [c.318]
Для отнесения вещества к какому-либо классу определяют его растворимость в ряде растворители (см. 3.1.3). Это же позволяет подобрать растворитель для перекристаллизации твердого вещества. В пробирку вносят каплю жидкого или около 0,01 г твердого исследуемого вещества и по каплям 0,2 мл растворителя. После добавления зсаждой капли пробирку встряхивают. Если соединение полностью растворилось, его регистрируют как растворимое, Если вещество плохо растворяется или совсем не растворяется при комнатной температуре, смесь нагревают до кнпеиин. При плохой растворимости в растворах кислот и щелочей твердый остаток отфильтровывают, а фильтрат нейтрализуют.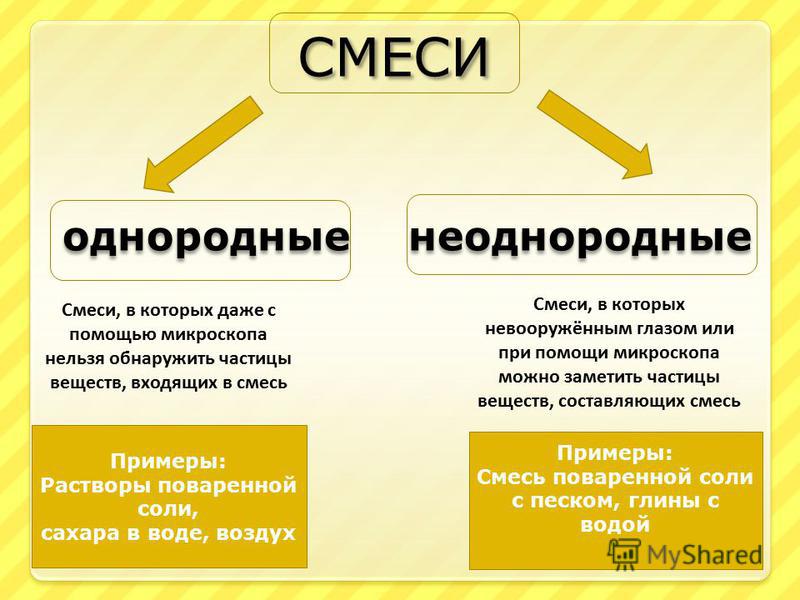 Е-го помутнение указывает на кислые или основные свойства вещества. [c.94]
Е-го помутнение указывает на кислые или основные свойства вещества. [c.94]
Для большинства зданий и сооружений рассматриваемых предприятий категория производства может быть определена простейшим путем — только по основным (показателям пожарной опасности нефти и нефтепродуктов (по температуре вспышки и пределу воспламенения) без расчетов по образованию взрывоопасной смеси, так как нефть и нефтепродукты обычно обращаются в больших количествах. Для производств с обращением сравнительно небольшого количества горючих веществ категории опасности производств определяют исходя из свойств и количества горючих веществ, которые могут образовывать взрывоопасную смесь в помещении. Категории производств определяются по аварийным условиям, связанным с возможным поступлением взрывопожароопасных веществ в помещение, или другим условиям, установленнььм технологами, при которых возможно образование взрывоопасных смесей. Определение свойств веществ, характеризующих их взры- [c. 26]
26]
Так, после чтения первых двух абзацев учащиеся выделяют такую мысль мельчайшими частицами некоторых веществ (воды, сахара) являются молекулы. Следующий абзац расширяет знания по вопросу, поставленному в начале параграфа (из чего состоят вещества ) есть вещества немолекулярного строения. Затем учащиеся делают вывод чистые вещества молекулярного строения состоят из одинаковых молекул. После этого выделяют мысль о том, что судить о свойствах веществ можно лишь тогда, когда они чистые смесь состоит из разных веществ, которые сохраняют свои свойства, и благодаря этому составляьэщие смесь вещества можно отделить друг от друга. Так разделяют, например, смесь серы и железа. [c.42]
Взрывчатые свойства гексила. Гексил менее чувствителен к удару, чем тетрил, и больше, чем пикриновая кислота. Чувствительность к детонации. По Маршалю, для полной детонации названных ниже взрывчатых веществ необходимы следующие минимальные количества инициирующего взрывчатого вещества (смесь гремучей ртути с бертолетовой солью) [c. 366]
366]
На рис. 5 показана зависимость температуры кипения нормальных парафинов и относительной гомологической разности Д от. молекулярной массы Д быстро убывает с ростом молекулярной массы, а так как в пределах одного гомологического ряда физические свойства вещества определяются только размерами молекулы, то уменьшается также и разница в температуре кипения. Разделение смеси химически близких веществ основывается на различии физических свойств ее составных компонентов. Однако с повышением молекулярной массы это различие для соседних членов гомологического ряда становится все меньше, поэтому их разделение будет тем труднее, чем больше молекула У полнмергомологи-ческого ряда высокомолекулярных соединений, где относительное значение гомологической разности составляет уже долю процента, физические свойства соседних членов ряда настолько сближаются, что разделение таких полимергомологов невозможно (по крайней мере, в настоящее время неизвестны методы, пригодные для этой цели). В лучшем случае полимергомологическая смесь может быть [c.22]
В лучшем случае полимергомологическая смесь может быть [c.22]
При рассмотрении пространственной модели бутанола-2 (рис. 78) видно, что возможны два различных расположения метила, этила, водорода и гидроксила. Эти структуры (I) и (II) являются взаимными зеркальными отражениями (энантиоме-рами, оптическими антиподами), не совместимыми друг с другом в пространстве, и, следовательно, самостоятельными соединениями. Химические и физические свойства этих двух форм (I) и (II) одинаковы во всем, за исключением того, что эти формы вращают плоскость поляризации плоскополяризованного света в равной степени, но в противоположных направлениях. Это и понятно, ибо физико-химические свойства вещества определяются в основном энергиями связей и расстояниями отдельных атомов друг от друга. Все эти величины в энанти-омерах одинаковы. 2-Бу анол, образующийся, например, при восстановлении метилэтилкетона, не обладает оптической активностью из-за того, что представляет собой смесь равного числа молекул одного и другого энантиомеров. Такая смесь называется рацемической. [c.435]
Такая смесь называется рацемической. [c.435]
Разделение изотопов физико-химическими методами основано на различии значений нулевой энергии молекул О, содержащих разные изотопы элемента. Нулевая энергия входит в виде существенного слагаемого в термодинамические функции, определяющие многие физико-химические свойства веществ. Изменения в её величине влияют на летучесть, константу равновесия, скорость реакции и т. д. Различие этих свойств используют при разделении изотопов химических элементов, входящих в состав веществ, представляющих собой смесь молекул с различным изотопным замещением. Смеси веществ, используемых для разделения, носят названия рабочих систем. Эти рабочие системы двухфазны (жидкость-пар, газ-твёрдое тело, жидкость-жидкость) и многокомпонентны. Так, например, обычная вода, находящаяся в равновесии со своим паром содержит 18 молекул, различающихся изотопным составом Н1бО, О О, Т О, НВ О, НТ О, ВТ О, Н О, О О, Т О, НО О, НТ О, ВТ О, Т1 0, Н01 0, НТ О, ОТ О. [c.229]
[c.229]
Поведение соединений с сопряженными двойными связями изучено довольно подробно [9]. Они вступают в реакцию с тетраацетатом свинца гораздо легче, чем простые олефины. Скорости реакций в зависимости от индивидуальных свойств веществ меняются в широких пределах, быстро возрастая в ряду диметил-бутадиен, циклогексадиен и циклопентадиен (38). Два первых вещества присоединяют ацетатные группы главным образом в положение 1,2. Присоединение к циклопентадиену происходит в 1,2- и 3,4-положения, приводя в обоих случаях к смеси цис-и транс-изоиеров [38]. Состав смеси находится в зависимости от растворителя. Окисление циклопентадиена, а в меньшей степени и циклогексадиена и анетола сопровождается окислением уксусной кислоты в гликолевую. Последняя реакция замечательна тем, что она идет в условиях, в которых ни сама уксусная кислота, ни ее производные не окисляются. Главными продуктами окисления циклопентадиена является смесь эфиров (39) и (40). Аналогичные продукты получаются при окислении тетрапропио-натом и тетрабутиратом свинца, в то время как с тетрабензоатом свинца образуется с хорошим выходом нормальный продукт реакции (41) в гране-форме [c. 149]
149]
ГАЗОВЫЕ РАСТВОРЫ — растворы газов, жидкостей и тнердых тел в газах. Величина давления пара над жидкостью и твердым телом зависи от свойства вещества н его темя-ры. Если вещество находится в открытом сосуде в соприкосновении с во.зд.ухом, а давление его нара меньше атмосферного, то над этим веществом находится не чистый нар, aero смесь, И.ЛИ, правильнее, раствор в воздухо. Исследуя эти явления при давлениях, близких к атмосферному, Далы он пришел к выводу, что количесово пара, на-с1,1щающого данный объем, не зависит от природы газа и его давления, а мольная доля растворенного в-ва в газовой фазе N.- равна Л. == рЦР, где — давление пара этого вещества нри данной темн-ре, Р — общее давление. Теперь известно, что да ке ири [c.379]
Однако алхимики накопили много важных эмпирических данных. Они открыли и описали ряд новых простых веществ и соединений фосфор, мышьяк, висмут, многие соли, соляную и азотную кислоты, играющие огромную роль в современной химической промышленности. Алхимики впервые применили царскую водку (смесь азотной и соляной кислот) для растворения серебра с целью отделения его от золота и т. д. Поскольку отдельные вещества имеют специфическую окраску, обладают характерным запахом (сера, хлор, эфиры, аммиак и т. д.), то в первую очередь описывались эти непосредственно воздействующие на органы чувств свойства веществ, а также такие, как агрегатное состояние, форма кристаллов или аморфность и т. д. В 1669 г. немецкий алхимик Бранд, прокаливая сухой остаток нынаренной человеческой мочи, наблюдал его зеленое свечение в темноте. Это способное к свечению вещество получило название носитель света , или по-гречески фосфор . Так же чисто случайно, эмпирически, во время безуспешных попыток [c.287]
Алхимики впервые применили царскую водку (смесь азотной и соляной кислот) для растворения серебра с целью отделения его от золота и т. д. Поскольку отдельные вещества имеют специфическую окраску, обладают характерным запахом (сера, хлор, эфиры, аммиак и т. д.), то в первую очередь описывались эти непосредственно воздействующие на органы чувств свойства веществ, а также такие, как агрегатное состояние, форма кристаллов или аморфность и т. д. В 1669 г. немецкий алхимик Бранд, прокаливая сухой остаток нынаренной человеческой мочи, наблюдал его зеленое свечение в темноте. Это способное к свечению вещество получило название носитель света , или по-гречески фосфор . Так же чисто случайно, эмпирически, во время безуспешных попыток [c.287]
Кошкиным было проведено изучение влияния аммиака на хлоропоглощаемость различных органических веществ. Согласно полученным им результатам, хлоропоглощаемость веществ первой группы (см. классификацию веществ по хлоропоглощаемости на стр. 35) в несколько раз пони-лмется в присутствии аммиака. Для веществ второй группы уменьшение хлоропоглощаемости составляет несколько процентов от начальной величины. На хлоропоглощаемость веществ третьей группы аммиак не оказывает действия. Смесь из веществ первой и второй групп имеет в отношении нониження хлоропоглощаемостп в присутствии аммиака свойства веществ второй группы. Прибавление веществ третьей группы не оказывает никакого влияния на поведение смеси. [c.42]
35) в несколько раз пони-лмется в присутствии аммиака. Для веществ второй группы уменьшение хлоропоглощаемости составляет несколько процентов от начальной величины. На хлоропоглощаемость веществ третьей группы аммиак не оказывает действия. Смесь из веществ первой и второй групп имеет в отношении нониження хлоропоглощаемостп в присутствии аммиака свойства веществ второй группы. Прибавление веществ третьей группы не оказывает никакого влияния на поведение смеси. [c.42]
Так как химические реакции приводят к образованию новых веществ, эти реакции должны сопровождаться изменениями физических свойств. Более того, снять эти изменения можно, только обратив химическую реакцию. Чтобы узнать, осуществилась ли химическая реакция, химики ищут изменений физических свойств вещества. Так, когда углерод сгорает в кислороде с образованием двуокиси углерода, исчезает твердое черное вещество — углерод, и его место занимает бесцветный, не обладающий запахом газ, который не горит. Если металлические опилки смешать с порошком серы, физические свойства как серы, так и железа сохраняются неизмененными. Более того, смесь можно составить в любом отношении серы к железу. Если же эту смесь сильно нагреть, происходит химическая реакция. Продукт реакции ферро(П)сульфид, РеЗ, не напоминает ни железа, ни серы и индис ерентен к магниту. [c.60]
Если металлические опилки смешать с порошком серы, физические свойства как серы, так и железа сохраняются неизмененными. Более того, смесь можно составить в любом отношении серы к железу. Если же эту смесь сильно нагреть, происходит химическая реакция. Продукт реакции ферро(П)сульфид, РеЗ, не напоминает ни железа, ни серы и индис ерентен к магниту. [c.60]
Мы ознакомились с реакцией разложения. Ознакомимся теперь с другим типом реакций — с реакцией соединения. Смешаем 4 г порошка серы с 7 г порошка железа. Небольшую часть этой смеси всыпем в пробирку с водой и взболтаем. Заметим, что из этой смеси одна часть, более темная (железо), падает на дно, другая же часть, более желтая (сера), остается па поверхности жидкости. Это показывает, что приготовленная нами смесь не является однородным но своим свойствам веществом, а состоит из частей с различными свойствами. Другую часть приготоилен-ной смеси высыпем на бумагу и поднесем к ней магнит. Большая часть смеси пристанет к магниту. Будем осторожно потряхивать магнит над бумагой. Заметим, что при этом железо останется притянутым к магниту, сера же падает на бумагу. Это также подтверждает, что наша смесь не однородна, а состоит из частей с различными свойствами. Затем всыпем часть приготовленной смеси в сухую пробирку, укрепим ее в штативе и прогреем у дна пробирки. Как только смесь начнет раскаливаться, сейчас же уберем горелку (или спиртовку). Разогревание массы в пробирке будет продолжатьсяи после этого. Когда пробирка остынет, извлечем из нее спекшуюся массу. Полученное вещество не похоже ни на взятую смесь, ни на железо, ни на серу. Попробуем разделить это вещество на железо и серу. Опыт показывает, что ни взбалтыванием с водой, ни магнитом оно не разделяется на отдельные части. Из железа и серы в результате хими ческой реакции между ними получилось одно новое вещество с новыми свойствами, отличными от свойств железа и серы. Вещество это называется сульфидом железа. [c.9]
Будем осторожно потряхивать магнит над бумагой. Заметим, что при этом железо останется притянутым к магниту, сера же падает на бумагу. Это также подтверждает, что наша смесь не однородна, а состоит из частей с различными свойствами. Затем всыпем часть приготовленной смеси в сухую пробирку, укрепим ее в штативе и прогреем у дна пробирки. Как только смесь начнет раскаливаться, сейчас же уберем горелку (или спиртовку). Разогревание массы в пробирке будет продолжатьсяи после этого. Когда пробирка остынет, извлечем из нее спекшуюся массу. Полученное вещество не похоже ни на взятую смесь, ни на железо, ни на серу. Попробуем разделить это вещество на железо и серу. Опыт показывает, что ни взбалтыванием с водой, ни магнитом оно не разделяется на отдельные части. Из железа и серы в результате хими ческой реакции между ними получилось одно новое вещество с новыми свойствами, отличными от свойств железа и серы. Вещество это называется сульфидом железа. [c.9]
Свойства бетонной смеси
Для приготовления бетонов, отвечающих современным требованиям, необходимы высококачественные цемент и заполнители.
Свежеприготовленную смесь из этих материалов и воды, взятых в строго определенных пропорциях, называют бетонной смесью или товарным бетоном. Бетон и бетонная смесь — это разные состояния материала, с различными свойствами и требованиями, предъявляемыми к ним. Поэтому не следует смешивать эти два понятия.
Для получения бетона высокого качества помимо применения высококачественных материалов укладываемая бетонная смесь должна обладать определенными свойствами, соответствующимн выбранной технологии.
Одним из важных свойств бетонной смеси является удобоукладываемость — способность ее заполнять форму с наименьшими затратами труда и энергии, обеспечивая при этом максимальную плотность, прочность и долговечность бетона.
Удобоукладываемость смеси зависит от ее подвижности (текучести) и пластичности (связности), т. е. способности не расслаиваться при транспортировании и в процессе укладки. Показателем подвижности служит осадка конуса в сантиметрах или показатель жесткости, измеряемый в секундах.
Хотя увеличение содержания воды в бетоне увеличивает подвижность бетонной смеси и облегчает ее укладку, однако лишняя вода в бетоне вредна. Она увеличивает вероятность расслаивания бетонной смеси, увеличивает пористость и усадку бетона, что снижает его качество.
Форма, размеры зерен крупного заполнителя и характер его поверхности также влияют на подвижность бетонной смеси. При окатанной гладкой поверхности зерен гравия уменьшается трение между ними, т. е. увеличивается подвижность. Более крупный заполнитель имеет меньшую суммарную поверхность. Следовательно, при одинаковом количестве цементного теста его прослойки между зернами будут иметь большую толщину, что увеличивает подвижность смеси. С увеличением расхода песка или применении мелких песков повышается суммарная поверхность заполнителей, что снижает подвижность смеси. По этой же причине повышенный расход цемента при постоянном содержании воды снижает подвижность бетонной смеси, увеличивая прочность бетона. Вид цемента, тонкость его помола также влияют на подвижность. Так, шлакопортландцемент, обладая большей водопотребностью, чем портландцемент, при одинаковом содержании воды обеспечивает меньшую подвижность смеси.
Так, шлакопортландцемент, обладая большей водопотребностью, чем портландцемент, при одинаковом содержании воды обеспечивает меньшую подвижность смеси.
Введение в бетонную смесь добавок поверхностно-активных веществ (ПАВ) увеличивает ее подвижность. Некоторые ПАВ, адсорбируясь в виде тончайших пленок на поверхности зерен заполнителя, снижают трение между ними. В результате увеличиваются подвижность и пластичность бетонных смесей. Такие добавки называют пластифицирующими.
Другая группа ПАВ — гидрофобизирующие—при перемешивании способствуют вовлечению в бетонную смесь мельчайших пузырьков воздуха, которые равномерно распределяются по всей ее массе. Такие добавки не только увеличивают подвижность и пластичность смеси, но и повышают морозостойкость и долговечность бетона.
Бетонные смеси с большой подвижностью (ОК=4 см и более) легче укладывать, т. е. они более технологичны. Трудоемкость и расход энергии на укладку жестких смесей, наоборот, больше. Хорошо уплотненные жесткие смеси позволяют получить более качественный бетон, чем, например, литые. Однако из-за большой трудоемкости укладки жесткие смеси иногда остаются недоуплотнен-ными, что снижает качество бетона.
Однако из-за большой трудоемкости укладки жесткие смеси иногда остаются недоуплотнен-ными, что снижает качество бетона.
На практике подвижность бетонных смесей принимают/ в зависимости от способов подачи их в блок бетонирования, а также от размеров конфигурации и степени армирования конструкций.
Осадка конуса бетонных смесей, перемещаемых ленточными транспортерами, не должна превышать 6 см, в противном случае смесь будет стекать с ленты транспортера. Подвижность бетонных смесей, перекачиваемых по трубопроводам с помощью бетононасосов или пневмонагнетателей, должна находиться в пределах 6— 12 см.
Под водоудерживающей способностью бетонной смеси понимают максимальный расход воды, при котором смесь сохраняет свою связность, т. е. не расслаивается. Это свойство зависит от водоудерживающей способности вяжущего, тонкомолотых добавок, а также количества и гранулометрического состава песка, размеров зерен и. формы поверхности крупного заполнителя. В бетонных смесях, содержащих большой излишек воды, после их укладки вплоть до полного схватывания наблюдаются процессы расслаивания и водоотделения.
ТЕХНОЛОГИЧЕСКИЕ СВОЙСТВА БЕТОННОЙ СМЕСИ
В производстве бетонных работ для оценки свойств бетонной смеси используют технические характеристики.
Самая важная характеристика — удобоукладываемость.
Удобоукладываемость — способность бетонной смеси заполнять форму при заданном способе уплотнения и образовывать в результате уплотнения плотную, однородную массу. В оценке удобоукладываемости используют три показателя: подвижность, жесткость и связность смеси.
Подвижность бетонной смеси определяют по осадке стандартного конуса (рис. 1).
Рис. 1. Определение удобоукладываемости бетонной смеси по осадке конуса:
1 — опоры; 2 — ручки; 3 — конус; ОК — осадка конуса
Усеченный конус изготовляют из тонкой листовой стали. Размеры конуса: высота 300 мм, диаметр нижнего основания 200, верхнего — 100 мм. Конус устанавливают на горизонтальной площадке, не впитывающей влагу. Берут пробу бетонной смеси, например, из авто-бетоносмесителя. Конус наполняют в три приема, каждый раз уплотняя смесь 25 ударами металлического стержня-штыковки. Поверхность смеси заглаживают, затем конус снимают и устанавливают рядом. Под действием силы тяжести бетонная смесь деформируется и оседает. Разность высот металлической формы конуса и осевшей бетонной смеси, выраженная в сантиметрах, характеризует подвижность смеси и называется осадкой конуса (ОК). С помощью этого показателя оценивают подвижность пластичных бетонных смесей.
Поверхность смеси заглаживают, затем конус снимают и устанавливают рядом. Под действием силы тяжести бетонная смесь деформируется и оседает. Разность высот металлической формы конуса и осевшей бетонной смеси, выраженная в сантиметрах, характеризует подвижность смеси и называется осадкой конуса (ОК). С помощью этого показателя оценивают подвижность пластичных бетонных смесей.
Жесткость смесей, у которых значение ОК = 0, характеризуют показателем жесткости, определяемым на приборе (рис. 2), который представляет собой металлический цилиндр 2 диаметром 240 мм и высотой 200 мм. Цилиндр устанавливают на лабораторнуювиброплощадку со стандартными характеристиками частоты (50 Гц) и амплитуды колебаний (0,5 мм в ненагруженном состоянии). Затем в цилиндр вставляют конус 3 и заполняют его бетонной смесью так же, как и при определении подвижности. После этого конус снимают и, поворачивая штатив, опускают стальной диск 4 на бетонную смесь. Общая масса диска с шайбой и штангой составляет около 2750 г, что создает при уплотнении пригруз 0,9 кПа. Включив виброплощадку, смесь подвергают вибрации до тех пор, пока цементное тесто не начнет выделяться из всех отверстий диска. В этот момент вибратор выключают. Время, необходимое для уплотнения смеси в приборе, называют показателем жесткости бетонной смеси (Ж) и выражают в секундах.
Включив виброплощадку, смесь подвергают вибрации до тех пор, пока цементное тесто не начнет выделяться из всех отверстий диска. В этот момент вибратор выключают. Время, необходимое для уплотнения смеси в приборе, называют показателем жесткости бетонной смеси (Ж) и выражают в секундах.
Рис. 2. Схема определения жесткости бетонной смеси:
а — прибор в исходном состоянии; б—после окончания вибрирования;
1 — виброплощадка; 2—цилиндр; 3 — конус с бетонной смесью; 4— диск с отверстиями; 5 — втулка; 6 — штанга; 7 — штатив
В зависимости от удобоукладываемости различают жесткие и подвижные бетонные смеси.
Связность — это способность бетонной смеси сохранять однородную структуру, т. е. не расслаиваться в процессе транспортирования, укладки и уплотнения. В результате уплотнения смеси частицы сближаются, а часть воды как наиболее легкого компонента отжимается вверх, образуя капиллярные ходы и полости под зернами крупного заполнителя. Крупный заполнитель, плотность которого отличается от плотности растворной части (смеси цемента, песка и воды), также перемещается в теле бетонной смеси. Если заполнитель плотный и тяжелый, например гранитный щебень, частицы его оседают (рис. 3 б), пористые легкие заполнители — керамзит, аглопорит — всплывают. Все это ухудшает структуру бетона, делает его неоднородным, увеличивает водопроницаемость и снижает морозостойкость. Чтобы повысить связность и предотвратить расслоение бетонной смеси, необходимо правильно назначать количество мелкого заполнителя в составе бетона, а также сокращать расход воды затворения, используя пластифицирующие добавки.
Если заполнитель плотный и тяжелый, например гранитный щебень, частицы его оседают (рис. 3 б), пористые легкие заполнители — керамзит, аглопорит — всплывают. Все это ухудшает структуру бетона, делает его неоднородным, увеличивает водопроницаемость и снижает морозостойкость. Чтобы повысить связность и предотвратить расслоение бетонной смеси, необходимо правильно назначать количество мелкого заполнителя в составе бетона, а также сокращать расход воды затворения, используя пластифицирующие добавки.
Рис. 3. Схема возможного расслоения бетонной смеси:
а — в процессе транспортирования и уплотнения; б — после уплотнения;
1 — направление, по которому отжимается вода; 2 — вода;
3,4 — мелкий и крупный заполнители
На удобоукладываемость бетонных смесей оказывает влияние содержание цементного теста, воды, вид цемента, крупность и форма зерен заполнителей, соотношение между крупным заполнителем и песком, чистота заполнителей, поверхностно-активные добавки.
Содержание цементного теста. Чем больше в бетонной смеси цементного теста (цемент + вода), тем выше ее удобоукладываемость. Цементного теста должно быть достаточно для заполнения пустот и обволакивания зерен заполнителей с некоторой раздвижкой. С толщиной слоя трение между зернами уменьшается, и удобоукладываемость бетонной смеси повышается.
Подвижность смеси при расходе цемента от 200 до 400 кг/м 3 зависит, в основном, от расхода воды. Эта закономерность называется законом постоянства водопотребности.
Содержание воды. С повышением содержания воды подвижность бетонной смеси увеличивается. Однако ее количество должно быть оптимальным, с тем, чтобы не происходило расслоения, которое сопровождается осаждением заполнителей и выделением воды на поверхности уложенного бетона. В бетоне на портландцементе этого не происходит при В/Ц не больше 1,65 нормальной густоты цементного теста. Добавки могут изменить эту «границу». Следует иметь также в виду, что с повышением расхода воды при постоянном расходе цемента увеличивается В/Ц, и прочность бетона понижается.
Вид цемента. Удобоукладываемость бетонной смеси зависит от нормальной густоты цементного теста. Так, пуццолановые портландцементы, в особенности с добавками диатомита и трепела, имеют высокую НГЦТ, образуют более вязкое цементное тесто, и бетонные смеси на них имеют худшую удобоукладываемость по сравнению со смесями на портландцементе.
Крупность заполнителей. С повышением крупности щебня, гравия, песка суммарная площадь их зерен уменьшается. Требуется меньше цементного теста, чтобы обволочь зерна, толщина прослоек между зернами увеличивается, удобоукладываемость бетонной смеси повышается.
Соотношение между крупным заполнителем и песком должно быть оптимальным с таким расчетом, чтобы пустотность их смеси была как можно меньше. При повышенном содержании песка удельная поверхность зерен повышается и бетонная смесь становится менее подвижной.
Форма зерен заполнителя. Лучшуюудобоукладываемость имеют бетонные смеси на заполнителях с гладкой поверхностью — гравии и речном или морском песке по сравнению с бетонными смесями на щебне и горном песке.
Чистота заполнителей. Пылевидные, и особенно глинистые, частицы в заполнителях отрицательно влияют на удобоукладываемость бетонных смесей. Они имеют большую удельную поверхность и повышенную водопотребность.
Поверхностно-активные добавки. Применение ПАВ (поверхностно-активных добавок), и в особенности пластификаторов, является одним из самых эффективных средств повышения удобоукладываемости бетонных смесей. Так, добавка ЛСТ снижает водопотребность бетонных смесей на 10-12, С-3 — на 20-30%. Эффективность их действия возрастает с увеличением содержания цемента, в жестких смесях — снижается.
Сухие строительные смеси: виды и свойства
Без сухих строительных смесей трудно представить строительство и ремонт – правильно выбранный состав облегчит выравнивание пола и стен, упростит финишную отделку и наклейку кафеля.
Чем хороши сухие строительные смеси? Прежде всего – это тщательно подобранный состав. Не нужно покупать и смешивать много разных материалов – цемент, песок, гипс, специальные химические компоненты и т. п. К тому же, смеси помогают обеспечить необходимое высокое качество работы. Так, в некоторые из них входят антиморозные добавки, которые позволяют работать с раствором при температуре до -15С и ниже. В то время как с обычным строительным раствором нельзя работать при минусовой температуре.
п. К тому же, смеси помогают обеспечить необходимое высокое качество работы. Так, в некоторые из них входят антиморозные добавки, которые позволяют работать с раствором при температуре до -15С и ниже. В то время как с обычным строительным раствором нельзя работать при минусовой температуре.
Различные добавки, которые вводят в сухую строительную смесь, придают ей специальные свойства. Эти составы применяют для самых разных работ.
Полы. Если для выравнивания пола использовать традиционный песчано-цементный «коктейль», возникнут две проблемы. Во-первых, качественно выполнить заливку сможет только специалист; во-вторых, цементная смесь, высыхая, дает усадку, в результате появляются трещины. Избежать проблем помогут сухие строительные смеси для выравнивания полов, свойства которых усовершенствованы благодаря наличию полимеров и пластификаторов.
Составы для выравнивания пола бывают двух видов: первый применяют для первоначальной обработки пола, если его уровень заметно колеблется (от 20 до 100 мм), вторые предназначены для финишного выравнивания. Cмеси для грубого выравнивания состоят из цемента, песка и различных полимерных добавок и не дают идеально гладкой поверхности. Чтобы такую получить, используют второй вид составов – самовыравнивающиеся смеси. В их основе уже не цемент, а гипс с полимерными добавками и пластификаторами. Этот материал очень пластичен, поэтому некоторые гипсовые смеси можно распределять, даже не пользуясь прокатным валиком. Правда, стоят они недешево. Альтернатива гипсу – цементные смеси со свойствами самовыравнивания.
Cмеси для грубого выравнивания состоят из цемента, песка и различных полимерных добавок и не дают идеально гладкой поверхности. Чтобы такую получить, используют второй вид составов – самовыравнивающиеся смеси. В их основе уже не цемент, а гипс с полимерными добавками и пластификаторами. Этот материал очень пластичен, поэтому некоторые гипсовые смеси можно распределять, даже не пользуясь прокатным валиком. Правда, стоят они недешево. Альтернатива гипсу – цементные смеси со свойствами самовыравнивания.
Некоторые составы нужно распределять с помощью специального инструмента – прокатного игольчатого валика – так удаляются пузырьки воздуха. Другие растекаются по поверхности пола сами и, застывая, образуют идеально ровный слой. Чтобы избежать пересыхания пола, лучше нанести на него пленкообразующий праймер или регулярно увлажнять покрытие в первые трое суток.
Стены. В классификации сухих строительных смесей для стен используется тот же принцип: есть составы для первоначальной обработки поверхности (оштукатуривания) и для финишной отделки (шпаклевания). Традиционно с помощью штукатурки устраняли ярко выраженные неровности стен и подготавливали их к дальнейшему выравниванию шпаклевкой. Современные производители сухих строительных смесей стремятся к универсальности: один и тот же продукт можно использовать как для заделки глубоких щелей и выбоин, так и для тонкослойного выравнивания. Достигается данный эффект за счет особого состава, в основе таких штукатурок не цемент, а гипс.
Традиционно с помощью штукатурки устраняли ярко выраженные неровности стен и подготавливали их к дальнейшему выравниванию шпаклевкой. Современные производители сухих строительных смесей стремятся к универсальности: один и тот же продукт можно использовать как для заделки глубоких щелей и выбоин, так и для тонкослойного выравнивания. Достигается данный эффект за счет особого состава, в основе таких штукатурок не цемент, а гипс.
Как и ровнители для пола, штукатурки для стен бывают двух видов: на основе гипса и цемента. Гипсовые штукатурки менее склонны к образованию трещин, зато цементные не боятся воды, поэтому их сфера применения различна. Штукатурки на основе цемента обычно используют для наружных работ и в помещениях с высокой влажностью, гипсовые применяют для решения остальных ремонтных задач. Суперэластичная гипсовая штукатурка легко наносится и выравнивается, высыхая, она не дает усадки. Новые разработки коснулись и составов на основе цемента.
Плитка. При укладке кафеля без сухих строительных смесей трудно обойтись: одни понадобятся для наклеивания плитки, другие – для затирки швов. Клей для кафельной плитки нужно выбирать, исходя из условий, в которых она будет эксплуатироваться. Для наружных работ используют морозостойкий состав, термостойкий пригодится для облицовки, например, камина. В ванной или бассейне применяются составы с защитой от воздействия влаги.
При укладке кафеля без сухих строительных смесей трудно обойтись: одни понадобятся для наклеивания плитки, другие – для затирки швов. Клей для кафельной плитки нужно выбирать, исходя из условий, в которых она будет эксплуатироваться. Для наружных работ используют морозостойкий состав, термостойкий пригодится для облицовки, например, камина. В ванной или бассейне применяются составы с защитой от воздействия влаги.
Немаловажным фактором при выборе клея является вес кафеля. Для тяжелой плитки, керамогранита, натурального камня нужна специальная рецептура. Ее эффективность производители испытывают практическим путем: плитку наклеивают, а через сутки проверяют ее на отрыв.
Кладка. Еще один вид сухих строительных смесей – это составы для кладки. Они состоят из цемента, песка и различных добавок, и имеют ряд особенностей. Так, кладочные растворы для печей обладают огнеупорными свойствами, а растворы для работы зимой содержат противоморозные компоненты. С использованием сухих строительных смесей может выполняться так называемая тонкая кладка с толщиной шва 2-3 мм, поэтому их расход невелик.
С использованием сухих строительных смесей может выполняться так называемая тонкая кладка с толщиной шва 2-3 мм, поэтому их расход невелик.
Кроме того, сухие строительные смеси незаменимы при кладке блоков из ячеистого бетона – ведь использование обычного цементного раствора снижает теплоизоляционные свойства газоблоков на 20-30%.
С помощью сухих смесей можно создать водостойкий барьер, который защищает поверхность от разрушительного воздействия влаги. Это имеет значение как при закладке фундаментов или других бетонных конструкций заглубленного типа, так и при ремонте кухни или ванной.
Свойства растворных смесей и растворов
Естественно, что свойства свежеприготовленной растворной смеси и затвердевшего раствора совершенно различны. Основными свойствами растворной смеси являются удобоукладываемость, пластичность (подвижность) и водоудерживающая способность, а затвердевших растворов — плотность, прочность и долговечность.

Правильный выбор области применения растворов всецело зависит от их свойств.
Свойства растворных смесей
Удобоукладываемость — свойство растворной смеси легко укладываться плотным и тонким слоем на пористое основание и не расслаиваться при хранении, транспортировании и перекачивании насосами.Она зависит от пластичности (подвижности) и водоудерживающей способности смеси.
Пластичность смеси характеризуют ее подвижностью, т. е. способностью растекаться под действием собственного веса или приложенных к ней внешних сил.
Подвижность почти всех растворных смесей определяют глубиной погружения (в см) стандартного конуса массой (300:4:2) г.
Высота конуса 180 мм, диаметр основания 150 мм, угол при вершине 30 °.
В лаборатории конус устанавливают на штативе (рис. 1,а), в условиях строительной площадки его подвешивают на цепочке с кольцом (рис. 1,6).
|
Рис.  1. Штатив 1. Штатив
|
Конус 3, удерживаемый за кольцо, подносят к смеси так, чтобы он вершиной касался ее поверхности. Затем конус отпускают и он погружается в смесь под
действием собственного веса.
По делениям на шкале 6 или на поверхности конуса определяют глубину погружения его в смесь.Если конус погрузился на глубину 6 см, это значит, что
подвижность растворной смеси равна 6 см.
Подвижность растворной смеси зависит прежде всего от количества воды и вяжущего, вида вяжущего и заполнителя, соотношения между вяжущим и заполнителем.
Жирные растворные смеси подвижнее тощих. При прочих равных условиях растворы на извести и глине более подвижны, чем на цементе; растворы на природном
песке подвижнее растворов на песке искусственном (дробленом).
Вид вяжущего подбирают и состав раствора задают в зависимости от требуемой прочности раствора и условий эксплуатации здания.
Подвижность растворной смеси можно регулировать, увеличивая или уменьшая расход вяжущею или воды. Увеличивая в растворной гмеси содержание воды и вяжущего,
получают более пластичные (подвижные) и удобоукладываемые смеси
Увеличивая в растворной гмеси содержание воды и вяжущего,
получают более пластичные (подвижные) и удобоукладываемые смеси
Удобоукладываемая растворная смесь получается при правильно назначенном зерновом составе ее твердых составляющих (песка, вяжущего, добавки). Тесто вяжущего
не только заполняет пустоты между зернами песка, но и равномерно обволакивает песчинки тонким слоем, уменьшая внутреннее трение.
Растворная смесь с нормальной водоудерживающей способностью — удобообрабатываемая и удобоукладываемая, мягкая, не тянется за лопатой штукатура,
обеспечивает высокую производительность труда.
От удобоукладываемости смеси зависит качество каменной кладки и штукатурки.
Правильно подобранная и хорошо перемешанная растворная смесь плотно заполняет неровности, углубления, трещины в основании, поэтому получается большая
площадь контакта между раствором и основанием, в результате возрастает монолитность кладки и штукатурки, увеличивается их долговечность.
Расслаиваемость — способность растворной смеси разделяться на твердую и жидкую фракции при транспортировании и перекачивании ее по
трубам и шлангам.
Растворную смесь часто перевозят автосамосвалами и перемещают по трубопроводам с помощью растворонасосов. При этом не редки случаи, когда смесь разделяется
на воду (жидкая фаза) и песок и вяжущее (твердая фаза), в результате чего в трубах и шлангах могут образоваться пробки, устранение которых связано с
большими потерями труда и времени.
Расслаиваемость растворной смеси определяют в лаборатории.
Проверить смесь на расслаиваемость упрощенно можно так. В ведро помещают растворную смесь слоем высотой около 30 см и определяют ее подвижность эталонным
конусом. Через 30 мин снимают верхнюю часть раствора (около 20 см) и вторично определяют глубину погружения конуса. Если разность значений погружения
конуса близка нулю, то растворную смесь считают нерасслаивающейся, если она находится в пределах 2 см — смесь считают средней расслаиваемости.
Разность значений погружения конуса более 2 см свидетельствует о том, что растворная смесь расслаивается.
Если состав растворной смеси подобран правильно и водовяжущее отношение назначено верно, то растворная смесь будет подвижной, удобоукладываемой, она будет
обладать хорошей водоудерживающей способностью и не будет расслаиваться.
Пластифицирующие добавки как неорганические, так и органические повышают водоудерживающую способность растворных смесей и уменьшают их расслаиваемость
Смотрите также:
Свойства растворов
Водонепроницаемость, морозостойкость, усадка строительных растворов
Теплофизические свойства смеси инертных газов
Соотношения для расчета характеристик
чистых компонентов гелия He, криптона Kr, и ксенона Xe в рассматриваемом
диапазоне температур и давлений показаны в предыдущих разделах.
Термодинамические характеристики всех трех газов в первом приближении можно
описать уравнением состояния идеального газа pv = RT с малыми поправками
на парные (и тройные для ксенона Xe) взаимодействия. Транспортные свойства, т.е. коэффициент динамической вязкости, теплопроводности
и т.д. можно описать, используя молекулярно-кинетическую теорию разреженных
газов для парных межатомных взаимодействий. При этом необходимо учитывать тройные
столкновения, которые определяют первые плотностные поправки к кинетическим
коэффициентам.
Транспортные свойства, т.е. коэффициент динамической вязкости, теплопроводности
и т.д. можно описать, используя молекулярно-кинетическую теорию разреженных
газов для парных межатомных взаимодействий. При этом необходимо учитывать тройные
столкновения, которые определяют первые плотностные поправки к кинетическим
коэффициентам.
Эти представления можно применить и к смесям рассматриваемых газов.
Анализ теплофизических характеристик
неплотных смесей инертных газов при высоких температурах проведен в работе
[25], где обобщение данных о втором вириальном и кинетических коэффициентах
выполнено одновременно для всех чистых инертных газов и их смесей по принципу
собственных состояний. В работе [26] разнородные экспериментальные данные для
чистых инертных газов и их смесей были взяты за основу для восстановления шести
параметрических потенциалов парных взаимодействия U(r). Получено удовлетворительное согласование основных массивов
экспериментальных данных и справочных значений [26], полученных по результатам,
приведенным в работе [22]. Основным аргументом для обоснования достоверности
разработанных рекомендаций можно считать согласованность характеристик,
проведенную на основе теоретических моделей для потенциалов взаимодействий, и
полуэмпирических моделей для принципа соответственных состояний.
Основным аргументом для обоснования достоверности
разработанных рекомендаций можно считать согласованность характеристик,
проведенную на основе теоретических моделей для потенциалов взаимодействий, и
полуэмпирических моделей для принципа соответственных состояний.
Приведенные ниже корреляции используют соотношения молекулярно-кинетической теории разреженных и неплотных газов и газовых смесей, приведенные в работе [22]. Обобщение зависимостей второго вириального коэффициента и интегралов столкновения проведено на основе соотношений, приведенных в работе [25]. Расчеты проводились с учетом высоких температур.
Удельный объем, плотность
Удельный объем (на единицу массы смеси), м3/кг, [22]:
(1)
где R = R*/M — удельная газовая постоянная,
R* = 8314,51 ± 0,14 Дж/(моль·K) — универсальная газовая постоянная.
(2)
M — молекулярный вес смеси компонентов,
Xi — мольные доли компонентов, Mi — мольные
веса компонентов, таблица ниже.
(3)
(4)
(5)
(6)
(7)
(8)
значения dij, eij и ai приведены в таблицах ниже.
Удельная изобарная теплоемкость
Удельная изобарная теплоемкость, Дж/(кг·K), [13]:
(9)
где давление P в Пa, температура T в K, R и B приведены выше. Погрешность определяется погрешностью для R, погрешностью заданных мольных долей смеси и погрешностью теплоемкостей составляющих смеси.
Удельная изохорная теплоемкость
Удельная изохорная теплоемкость, Дж/(кг·K), [15]:
(10)
где давление P в Пa, температура Т в К, R и B приведены выше. Погрешность рассчитывается, как сказано ранее.
Показатель адиабаты (изоэнтропы)
Показатель изоэнтропы, [13]:
(11)
где давление P измеряется в Пa, V — в м3/кг.
Скорость звука
Скорость звука, м/с, [13]:
(12)
Удельная энтальпия
Удельная энтальпия, Дж/кг, [13]:
(13)
где давление P в Пa, температура Т в К, R и B приведены выше. Погрешность меньше 0,5 % при точном задании состава смеси.
Удельная энтропия
Удельная энтропия, Дж/(кг·K), [15, 26]:
(14)
где давление P измерено в Пa, температура Т — в К, R и B показаны выше, Sio по таблице ниже. Погрешность менее 0,5 % при точном задании состава смеси.
Коэффициент динамической вязкости
Коэффициент динамической вязкости, Па·с, [22, 9]:
(15)
Для вязкости смеси в разреженном состоянии βo(T, x) имеется строгое решение, но оно приводит к сложным соотношениям. Рекомендуется ограничиться более простым соотношением:
(16)
где
(17)
(18)
Плотностная поправка в (2. 8.15):
8.15):
(19)
где
(20)
где bio по формуле (6), T*i=T/ei, рассчитаны по формулам (5) и (6) для значений bi и ei. Величина погрешности определения β смеси при T = 300 ÷ 1500 К менее 2,5 %, а при T = 1500 ÷ 2500 К не превышает 4 %.
Коэффициент теплопроводности
Коэффициент теплопроводности, Вт/(м·K). При расчете коэффициента теплопроводности применено простое соотношение:
(21)
где
(22)
где φij рассчитаны по формуле (17),
(23)
Поправка на плотность рассчитывается по формуле:
(24)
где
(25)
Значения ci в (5), показаны в таблице ниже.
Погрешность определения α смеси при температуре в диапазоне
T = 300
— 1500 К
не превышает 2 %, а при температуре в диапазоне T = 1500 — 2500 К не превышает
3 %.
Прочие характеристики
Соотношение δ = β/r используется для расчета коэффициента кинематической вязкости; γ = α/(Hpr) – для коэффициента температуропроводности, и ε = δ/γ – для числа Прандтля.
область применения, свойства смеси, достоинства и недостатки
Водопроницаемость бетона обозначается литерой «W» и числовым значением рядом с ней, определяющим большую или меньшую степень поглощения жидкости. Является одним из важнейших параметров, определяющих область применения готовых смесей и возможность изготовления из них различных строительных конструкций.
Одной из наиболее популярных в частном и коммерческом строительстве марок бетона, является состав с водопроницаемостью W4. Стоит подробней рассмотреть его особенности, характеристики и область применения при выполнении практических строительных работ.
Свойства смеси
Характеристики водопроницаемости, определяют способность бетона, поглощать воду из окружающей среды или при непосредственном контакте с жидкостью. Данная особенность определяется составом материалам и количеством пор внутри него. Бетон W4 относится к материалам со средним уровнем водопроницаемости. Он способен поглощать до 5,7% воды от собственной массы. Данный показатель хоть и является достаточно невысоким, но все же, смесь не рекомендуется для проведения наружных работ и изготовления капитальных несущих элементов.
Данная особенность определяется составом материалам и количеством пор внутри него. Бетон W4 относится к материалам со средним уровнем водопроницаемости. Он способен поглощать до 5,7% воды от собственной массы. Данный показатель хоть и является достаточно невысоким, но все же, смесь не рекомендуется для проведения наружных работ и изготовления капитальных несущих элементов.
Достоинства и недостатки
Вода, впитываемая бетоном, негативно сказывается на его эксплуатационных свойствах и эксплуатационных характеристиках помещений в которых использованы конструкции изготовленные на его основе. В частности вода оказывает следующее действие:
- Увеличивает процент промерзания смеси – снижаются характеристики теплопроводности, вода заполняющая поры при замерзании и расширении, может вызвать растрескивание поверхности и привести к крошению бетона. Если контакт с жидкой средой происходит постоянно или очень часто, со временем такие элементы и детали приходят в негодность и требуют замены или капитального ремонта;
- Образование плесени – поверхность насыщенная влагой, является оптимальной средой для развития и распространения плесени и грибка.
 Наличие вредоносных микроорганизмов, негативно сказывается на микроклимате помещения, а также способствует разрушению отделочных материалов использованных для декорирования основания.
Наличие вредоносных микроорганизмов, негативно сказывается на микроклимате помещения, а также способствует разрушению отделочных материалов использованных для декорирования основания.
Тем не менее, бетон W4 имеет и важное преимущество – он дешевле бетонов с низким уровнем поглощения воды, что обусловлено особенностями его состава, а именно, сравнительно меньшим содержанием цемента и использованием недорогих материалов заполнителей. Таким образом, можно хорошо сэкономить, используя материал на участках, где исключен контакт с влагой или влажной средой.
Область применения
Так как бетона марки W4 имеет сравнительно высокие параметры поглощения влаги, его рекомендуется использовать внутри помещения, для изготовления стежек и других элементов в конструкции сухих помещений, не имеющих контакта с внешней, уличной средой. Для повышения эксплуатационных характеристик, рекомендуется дополнительная гидроизоляция бетона при помощи наливных, наплавляемых и других гидроизоляционных материалов.
Для изготовления фундаментов, каркасных элементов наружных бетонных конструкций, рекомендуется использовать бетона марок W6, отличающийся более высокой ценой, но практически не впитывающий влагу и отлично подготовленный к эксплуатации в условиях постоянного контакта с влажной средой, осадками и прочими факторами способными повлиять на эксплуатационные свойства материала.
Узнать марку бетона и особенности по свойствам впитывания влаги, можно у непосредственного производителя смеси. Определить это опытным путем практически невозможно, нужно знать состав материала. Поэтому при заказе в обязательном порядке нужно уточнять характеристики водопроницаемости бетона, указывая нужную марку.
Назначение и свойства формовочных материалов и смесей
Разовые литейные формы и стержни изготовляют из материалов, которые называют формовочными. Различают исходные формовочные материалы, формовочные и стержневые смеси, а также вспомогательные формовочные составы.
Назначение. Исходные формовочные материалы разделяют на основные и вспомогательные.
К основным относят пески, являющиеся огнеупорной основой смесей, и связующие (глины, смолы и т. д.), соединяющие частицы песка между собой. Вспомогательные исходные материалы (различные добавки) предназначены для придания смесям специальных свойств, например повышенной газопроницаемости.
Для получения формовочных и стержневых смесей смешивают различные исходные формовочные материалы, при этом состав смеси и количество входящих в нее компонентов зависят от назначения смеси. Кроме свежих исходных формовочных материалов в состав смеси обычно входит бывшая в употреблении смесь, подвергнутая специальной обработке (например, охлаждению, дроблению, магнитной сепарации, просеиванию, увлажнению).
Вспомогательные формовочные составы (краски, клеи, пасты) предназначены для улучшения качества поверхности форм и стержней, придания ей определенных свойств, для соединения частей стержней.
Свойства смесей. Качество форм и стержней определяется свойствами формовочных и стержневых смесей, которые должны отвечать определенным требованиям.
Текучесть — это способность смесей перемещаться под действием внешних усилий и заполнять опоки и стержневые ящики.
Пластичность — это свойство смеси деформироваться под действием внешних усилий и сохранять полученную форму после удаления модели или стержневого ящика. Пластичность зависит от состава смеси, например в песчано-глинистых смесях от содержания в них глины и воды.
Прочность — способность смеси в уплотненном состоянии выдерживать не разрушаясь внешние воздействия. Она должна быть достаточной для того, чтобы формы и стержни не разрушались при их изготовлении, транспортировании, сборке и заливке расплавом.
Податливость — способность смеси в уплотненном состоянии деформироваться под действием сжимающих усилий, возникающих в процессе усадки при затвердевании и охлаждении отливок. При недостаточной податливости смеси в отливке могут образоваться трещины.
При недостаточной податливости смеси в отливке могут образоваться трещины.
Газопроницаемость — свойство смеси пропускать газы, выделяющиеся при заливке и охлаждении из расплава, из стержня и самой формы, а также воздух, находящийся в ее полости. При недостаточной газопроницаемости в отливках образуются газовые раковины и поры.
Огнеупорность — способность смеси не размягчаться и не расплавляться под действием теплоты заливаемого в форму расплава.
Термохимическая стойкость — свойство смеси не вступать в физическое и химическое взаимодействие с жидким металлом, его оксидами и газами, выделяющимися в процессе заливки форм. Низкая термохимическая стойкость приводит к образованию трудно отделимого пригара, ухудшающего качество поверхности отливок и затрудняющего их очистку.
Кроме того, смеси должны обладать достаточной живучестью, т. е. сохранять свои свойства после приготовления в течение заданного промежутка времени, малой газотворностью, т. е. не выделять большого количества газов в процессе заливки, выбиваемостью — легко удаляться из отливок после их охлаждения, негигроскопичностью.
е. не выделять большого количества газов в процессе заливки, выбиваемостью — легко удаляться из отливок после их охлаждения, негигроскопичностью.
3.4: Классификация вещества по его составу
Цели обучения
- Объясните разницу между чистым веществом и смесью.
- Объясните разницу между элементом и соединением.
- Объясните разницу между гомогенной смесью и гетерогенной смесью.
Один из полезных способов упорядочить наше понимание материи — это подумать об иерархии, которая простирается от самых общих и сложных до самых простых и фундаментальных (рисунок \ (\ PageIndex {1} \)).Материю можно разделить на две большие категории: чистые вещества и смеси. Чистое вещество — это форма вещества, которая имеет постоянный состав (это означает, что он везде одинаков) и свойства, которые постоянны во всем образце (это означает, что существует только один набор свойств, таких как точка плавления, цвет, кипение точка и т. д. по всему делу). Материал, состоящий из двух или более веществ, представляет собой смесь . Элементы и соединения являются примерами чистых веществ.Вещество, которое не может быть разбито на химически более простые компоненты, — это элемент . Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разбить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. Сегодня в известной нам вселенной около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
д. по всему делу). Материал, состоящий из двух или более веществ, представляет собой смесь . Элементы и соединения являются примерами чистых веществ.Вещество, которое не может быть разбито на химически более простые компоненты, — это элемент . Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разбить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. Сегодня в известной нам вселенной около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Обычная поваренная соль называется хлоридом натрия. Он считается веществом , потому что он имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода — тоже чистое вещество. Соль легко растворяется в воде, но соленую воду нельзя классифицировать как вещество, поскольку ее состав может варьироваться. Вы можете растворить небольшое или большое количество соли в определенном количестве воды.Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою индивидуальность и свойства в смеси . Только форма соли изменяется, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Все образцы хлорида натрия химически идентичны. Вода — тоже чистое вещество. Соль легко растворяется в воде, но соленую воду нельзя классифицировать как вещество, поскольку ее состав может варьироваться. Вы можете растворить небольшое или большое количество соли в определенном количестве воды.Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою индивидуальность и свойства в смеси . Только форма соли изменяется, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Гомогенная смесь представляет собой смесь, состав которой однороден по всей смеси. Описанная выше соленая вода является однородной, поскольку растворенная соль равномерно распределяется по всей пробе соленой воды.Часто легко спутать гомогенную смесь с чистым веществом, потому что они оба однородны. Разница в том, что состав вещества всегда одинаковый. Количество соли в соленой воде может варьироваться от одного образца к другому. Все растворы считаются однородными, поскольку растворенный материал присутствует в одинаковом количестве во всем растворе.
Все растворы считаются однородными, поскольку растворенный материал присутствует в одинаковом количестве во всем растворе.
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси.Овощной суп — это неоднородная смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Этап
Фаза — это любая часть образца, имеющая однородный состав и свойства. По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя.Каждый из слоев называется фазой.
Пример \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок с соотношением атомов алюминия и кислорода 2: 3
- селен
Дано : химическое вещество
Запрошен : его классификация
Стратегия:
- Определите, является ли вещество химически чистым.
 Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение.
Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение. - Если вещество не является химически чистым, это либо гетерогенная смесь, либо гомогенная смесь. Если его состав однороден во всем, это однородная смесь.
Решение
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрацией.
B) Поскольку состав раствора однороден повсюду, это однородная смесь . - A) Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым.
B) Апельсиновый сок, потому что его состав неоднороден, является гетерогенной смесью . - A) Компакт-диск — это твердый материал, содержащий более одного элемента, с видимыми по краям участками разного состава.
 Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой гетерогенную смесь. - A) Оксид алюминия представляет собой отдельное химически чистое соединение .
- A) Селен — один из известных элементов .
Упражнение \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ:
- гомогенная смесь (раствор)
- Ответ b:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ d:
- соединение
Пример \ (\ PageIndex {2} \)
Как бы химик классифицировал каждый образец вещества?
- соленая вода
- почва
- вода
- кислород
Решение
- Соленая вода действует так, как будто это единое вещество, даже если она содержит два вещества — соль и воду.
 Морская вода — это однородная смесь или раствор.
Морская вода — это однородная смесь или раствор. - Почва состоит из небольших кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество. Более конкретно, поскольку вода состоит из водорода и кислорода, она представляет собой соединение.
- Кислород, вещество, это элемент.
Упражнение \ (\ PageIndex {2} \)
Как бы химик классифицировал каждый образец вещества?
- кофе
- водород
- яйцо
- Ответ:
- однородная смесь (раствор), если это фильтрованный кофе
- Ответ b:
- элемент
- Ответ c:
- гетерогенная смесь
Резюме
Вещество можно разделить на две большие категории: чистые вещества и смеси.Чистое вещество — это форма вещества, имеющая постоянный состав и постоянные свойства во всем образце. Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из одного типа атомов.
Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из одного типа атомов.
Словарь
- Элемент: вещество, состоящее только из одного типа атомов.
- Соединение: вещество, состоящее из более чем одного типа атомов, связанных вместе.
- Смесь: комбинация двух или более элементов или соединений, которые не вступили в реакцию с целью связывания друг с другом; каждая часть смеси сохраняет свои свойства.
Материалы и авторство
Эта страница была создана на основе контента следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Chem4Kids.
 com: Matter: Mixtures
com: Matter: Mixtures Смеси везде, куда ни глянь. Большинство вещей в природе представляют собой смеси. Посмотрите на скалы, океан или даже на атмосферу. Все они смеси, и смеси имеют около физических свойств, , а не химические. Это утверждение означает, что отдельные молекулы любят находиться рядом друг с другом, но их основная химическая структура не меняется, когда они входят в смесь. Если бы химическая структура изменилась, это называлось бы реакцией.
Когда вы видите дистиллированную воду (H 2 O), это чистое вещество. Это означает, что в жидкости есть только молекулы воды. Смесь представляет собой стакан воды с растворенными в ней другими веществами, может быть, один из тех порошков, которые вы принимаете, если заболеете. Каждое из веществ в этом стекле сохраняет свои химические свойства. Итак, если у вас есть растворенных веществ в воде, вы можете вскипятить воду и все еще оставить растворенные вещества. Если вы добавили немного соли (NaCl) в воду, а затем вскипятили воду, соль останется в кастрюле.Соль остается, потому что для ее плавления требуется очень высокая температура (даже больше, чтобы ее вскипятить).
Если вы добавили немного соли (NaCl) в воду, а затем вскипятили воду, соль останется в кастрюле.Соль остается, потому что для ее плавления требуется очень высокая температура (даже больше, чтобы ее вскипятить).
Если положить песок в стакан с водой, он считается смесью. Всегда можно отличить смесь, потому что каждое из веществ может быть выделено из группы разными физическими способами. Вы всегда можете достать песок из воды, отфильтровав воду. Если вы были заняты, вы можете просто оставить смесь песка и воды в покое на несколько минут. Иногда смеси расслаиваются сами по себе. Когда вы вернетесь, вы обнаружите, что весь песок опустился на дно. Gravity помогала вам с разделением. Не забывайте, что смесь также может состоять из двух жидкостей. Даже такая простая вещь, как масло и вода, представляет собой смесь.
Иногда смеси расслаиваются сами по себе. Когда вы вернетесь, вы обнаружите, что весь песок опустился на дно. Gravity помогала вам с разделением. Не забывайте, что смесь также может состоять из двух жидкостей. Даже такая простая вещь, как масло и вода, представляет собой смесь.
Подробнее о смесях в части II …
Камни под микроскопом (видео Кембриджского университета)
элементов, соединений и смесей
элементов, соединений и смесей Элементы, соединения и смесиЭлементы
| Вид под микроскопом атомов элемента аргона (газовая фаза). | Вид под микроскопом молекул элемента азота (газовая фаза). |
Обратите внимание, что элемент:
- состоит только из одного вида атомов,
- нельзя разбить на более простой тип материи ни физическими, ни химическими средствами, а
- может существовать либо в виде атомов (например, аргона), либо в виде молекул (например, азота).

Молекула состоит из двух или более атомов одного и того же элемента или разных элементов, которые химически связаны вместе.Обратите внимание, что два атома азота, составляющие молекулу азота, движутся как единое целое.
Соединения
| Вид под микроскопом молекул соединения воды (газовая фаза). Атомы кислорода красные, а атомы водорода белые. |
Обратите внимание, что соединение:
- состоит из атомов двух или более различных элементов , связанных вместе ,
- можно разбить на более простой тип материи (элементы) химическим путем (но не физическим),
- имеет свойства, отличные от его составных элементов, а
- всегда содержит одинаковое соотношение составляющих его атомов.
Смеси
Вид под микроскопом газовой смеси, содержащей два элемента (аргон и азот) и соединение (вода). |
Обратите внимание, что смесь:
- состоит из двух или более различных элементов и / или соединений, физически смешанных,
- можно разделить на компоненты физическими средствами, а
- часто сохраняет многие свойства своих компонентов.
Классификация материи — Chemistry LibreTexts
Материю можно идентифицировать по ее характерной инерционной и гравитационной массе и занимаемому пространству. Материя обычно находится в трех различных состояниях: твердом, жидком и газообразном.
Введение
Вещество — это образец вещества, физические и химические свойства которого одинаковы во всем образце, поскольку вещество имеет постоянный состав. Часто можно увидеть, как вещества переходят из одного состояния в другое.Чтобы различать состояния материи хотя бы на уровне частиц, мы смотрим на поведение частиц внутри вещества. Когда вещества меняют свое состояние, это происходит потому, что расстояние между частицами веществ изменяется из-за увеличения или уменьшения энергии . Например, все мы, вероятно, наблюдали, что вода может существовать в трех формах с разными характерными способами поведения: твердое состояние (лед), жидкое состояние (вода) и газообразное состояние (водяной пар и пар).Из-за преобладания воды мы используем ее, чтобы проиллюстрировать и описать три различных состояния материи. По мере того, как лед нагревается и частицы вещества, из которых состоит вода, приобретают энергию, в конечном итоге лед тает, превращаясь в воду, которая в конечном итоге закипает и превращается в пар.
Например, все мы, вероятно, наблюдали, что вода может существовать в трех формах с разными характерными способами поведения: твердое состояние (лед), жидкое состояние (вода) и газообразное состояние (водяной пар и пар).Из-за преобладания воды мы используем ее, чтобы проиллюстрировать и описать три различных состояния материи. По мере того, как лед нагревается и частицы вещества, из которых состоит вода, приобретают энергию, в конечном итоге лед тает, превращаясь в воду, которая в конечном итоге закипает и превращается в пар.
Прежде чем мы исследуем состояния материи, мы рассмотрим некоторые способы классификации материи теми, кто изучал ее поведение.
Классифицирующие материалы
Данные свидетельствуют о том, что вещества состоят из более мелких частиц, которые обычно перемещаются.Некоторые из этих частиц материи могут быть разделены на более мелкие части, используя достаточно сильное тепло или электричество, на более мелкие, довольно однородные частицы, называемые атомами. Атомы — это строительные блоки элементов. Элементы — это все те вещества, которые никогда не разлагались или не разделялись на какие-либо другие вещества в результате химических реакций, воздействия тепла или попыток пропустить через образец постоянный электрический ток. Атомы, в свою очередь, состоят из еще более мелких единиц вещества, называемых электронами, протонами и нейтронами.
Атомы — это строительные блоки элементов. Элементы — это все те вещества, которые никогда не разлагались или не разделялись на какие-либо другие вещества в результате химических реакций, воздействия тепла или попыток пропустить через образец постоянный электрический ток. Атомы, в свою очередь, состоят из еще более мелких единиц вещества, называемых электронами, протонами и нейтронами.
Элементы могут быть организованы в так называемую периодическую таблицу элементов на основе наблюдаемого сходства химических и физических свойств различных элементов.Когда атомы двух или более элементов объединяются и связываются, образуется соединение. Образовавшееся соединение может быть позже разложено на чистые вещества, которые первоначально вступили в реакцию с его образованием.
Образовавшееся соединение может быть позже разложено на чистые вещества, которые первоначально вступили в реакцию с его образованием.
Соединения, такие как вода, состоят из более мелких единиц связанных атомов, называемых молекулами. Молекулы соединения состоят из той же пропорции элементов, что и соединение в целом, поскольку они являются наименьшими единицами этого соединения. Например, каждая порция пробы воды состоит из молекул воды.Каждая молекула воды содержит два атома водорода и один атом кислорода, поэтому вода в целом имеет в объединенном состоянии в два раза больше атомов водорода, чем атомов кислорода.
Вода может состоять из тех же молекул, но ее физические свойства могут измениться. Например, вода с температурой ниже 0 ° C — это лед, а вода с температурой выше 100 ° C — это газ, водяной пар. Когда вещество переходит из одного состояния в другое, в процесс могут быть вовлечены температура и давление, а также изменяются плотность и другие физические свойства. Температура и давление, оказываемые на образец вещества, определяют конечную форму этого вещества, будь то твердое, жидкое или газовое.
Температура и давление, оказываемые на образец вещества, определяют конечную форму этого вещества, будь то твердое, жидкое или газовое.
Поскольку свойства соединений и элементов однородны, они классифицируются как веществ . Когда два или более веществ смешиваются вместе, результат называется смесью. Смеси можно разделить на две основные категории: однородные и гетерогенные. Гомогенная смесь — это смесь, в которой состав компонентов однородно перемешан.Гомогенная смесь, в которой одно вещество, растворенное вещество, полностью растворяется в другом веществе, растворителе, также может называться раствором . Обычно растворитель представляет собой жидкость, однако растворенное вещество может быть жидким, твердым или газообразным. В гомогенном растворе частицы растворенного вещества равномерно распределены между частицами растворителя, и чрезвычайно мелкие частицы растворенного вещества не могут быть отделены от растворителя путем фильтрации через фильтровальную бумагу, потому что промежутки между бумажными волокнами намного больше, чем размер растворенного вещества и частицы растворителя. Другие примеры гомогенных смесей включают сахарную воду, которая представляет собой смесь сахарозы и воды, и бензин, который представляет собой смесь десятков соединений.
Другие примеры гомогенных смесей включают сахарную воду, которая представляет собой смесь сахарозы и воды, и бензин, который представляет собой смесь десятков соединений.
Гомогенные смеси: фильтрованная морская вода представляет собой раствор соединений воды, соли (хлорида натрия) и других соединений.
Гетерогенная смесь представляет собой неоднородную смесь, в которой компоненты разделяются и состав изменяется. В отличие от гомогенной смеси, гетерогенные смеси можно разделить с помощью физических процессов.Примером используемого физического процесса является фильтрация, которая позволяет легко отделить песок от воды в смеси песка и воды с помощью фильтровальной бумаги. Еще несколько примеров гетерогенных смесей включают заправки для салатов, камни и смеси масла и воды. Гетерогенные смеси, включающие, по меньшей мере, одну жидкость, также называются смесями суспензии и и разделяются, если они выдерживаются достаточно долго. Рассмотрим идею смешивания масла и воды вместе. Независимо от количества времени, затраченного на их встряхивание, в конечном итоге смеси масла и воды разделятся, и масло поднимется к верху смеси из-за его более низкой плотности.
Рассмотрим идею смешивания масла и воды вместе. Независимо от количества времени, затраченного на их встряхивание, в конечном итоге смеси масла и воды разделятся, и масло поднимется к верху смеси из-за его более низкой плотности.
Гетерогенные смеси: разделение песка и воды разделение заправок для салатов различных смесей в породе
Смеси, которые находятся между раствором и гетерогенной смесью, называются коллоидными суспензиями (или просто коллоидами). Смесь считается коллоидной, если она обычно не отделяется самопроизвольно или не осаждается с течением времени и не может быть полностью отделена фильтрованием через обычную фильтровальную бумагу. Оказывается, что смесь является коллоидной по своему поведению, если один или несколько из ее размеров длины, ширины или толщины находятся в диапазоне 1-1000 нм.Коллоидную смесь можно также распознать, пропустив через смесь луч света. Если смесь коллоидна, луч света будет частично рассеиваться взвешенными частицами нанометрового размера, и наблюдатель может наблюдать его. Это известно как эффект Тиндаля. В случае эффекта Тиндаля часть света рассеивается, поскольку длины волн света в видимом диапазоне, примерно от 400 нм до 700 нм, сталкиваются с взвешенными частицами коллоидного размера примерно одинакового размера.Напротив, если бы луч света проходил через раствор, наблюдатель, стоящий под прямым углом к направлению луча, не увидел бы света, отражающегося ни от единиц растворенного вещества, ни от формул растворителя, которые составляют раствор, поскольку частицы растворенного вещества и растворитель намного меньше длины волны видимого света, проходящего через раствор.
Это известно как эффект Тиндаля. В случае эффекта Тиндаля часть света рассеивается, поскольку длины волн света в видимом диапазоне, примерно от 400 нм до 700 нм, сталкиваются с взвешенными частицами коллоидного размера примерно одинакового размера.Напротив, если бы луч света проходил через раствор, наблюдатель, стоящий под прямым углом к направлению луча, не увидел бы света, отражающегося ни от единиц растворенного вещества, ни от формул растворителя, которые составляют раствор, поскольку частицы растворенного вещества и растворитель намного меньше длины волны видимого света, проходящего через раствор.
- Растворы: молекулы размером ~ 0,1-2 нм
- Коллоиды: молекулы размером ~ 2-1000 нм
- Суспензии: молекулы размером более ~ 1000 нм
Коллоидные смеси: Коллоидные смеси содержат компоненты, которые не имеют тенденции к осаждению.Молоко представляет собой коллоид жидких шариков молочного жира, взвешенных в воде
Рисунок \ (\ PageIndex {2} \): блок-схема разбивки материи.
Разделение смесей
Большинство веществ в природе встречаются в виде смесей, поэтому химик должен разделить их на природные компоненты. Один из способов удаления вещества — это физическое свойство магнетизма. Например, разделение смеси железа и серы может быть достигнуто, потому что куски железа будут притягиваться к магниту, помещенному в смесь, удаляя железо из оставшейся серы.Фильтрация — еще один способ разделения смесей. В ходе этого процесса твердое вещество отделяется от жидкости, проходя через мелкопористый барьер, такой как фильтровальная бумага. В этом процессе можно отделить песок и воду, при этом песок будет задерживаться за фильтровальной бумагой, а вода будет просачиваться сквозь нее. Другой пример фильтрации — отделение кофейной гущи от жидкого кофе через фильтровальную бумагу. Дистилляция — еще один метод разделения смесей. При кипячении раствора нелетучего твердого вещества, растворенного в жидкости, в колбе, пар из растворителя с более низкой точкой кипения может быть удален из раствора за счет тепла, конденсироваться обратно в жидкую фазу, когда он вступает в контакт с более холодными поверхностями. , и собираться в другой контейнер.Таким образом, такой раствор может быть разделен на его исходные компоненты, при этом растворитель собирается в отдельной колбе, а растворенное вещество остается в исходной дистилляционной колбе. Примером раствора, разделяемого дистилляцией, может быть дистилляция раствора сульфата меди (II) в воде, при которой вода выкипает и собирается, а сульфат меди (II) остается в перегонной колбе.
, и собираться в другой контейнер.Таким образом, такой раствор может быть разделен на его исходные компоненты, при этом растворитель собирается в отдельной колбе, а растворенное вещество остается в исходной дистилляционной колбе. Примером раствора, разделяемого дистилляцией, может быть дистилляция раствора сульфата меди (II) в воде, при которой вода выкипает и собирается, а сульфат меди (II) остается в перегонной колбе.
Состояния Материи
Все, что нам знакомо в нашей повседневной жизни — от земли, по которой мы ходим, до воды, которую мы пьем, и воздуха, которым мы дышим, — основано на состояниях материи , называемых газами, жидкостями и твердыми телами.
Твердые вещества
Когда температура жидкости понижается до точки замерзания вещества (для воды точка замерзания составляет 0 o ° C), движение частиц замедляется с изменением расстояния между частицами до тех пор, пока притяжение между частицами не заблокируется. частицы в твердую форму.В точке замерзания частицы плотно упакованы вместе и имеют тенденцию блокировать движение друг друга. Притяжения между частицами плотно удерживают частицы вместе, так что весь ансамбль частиц принимает фиксированную форму. Объем твердого тела постоянен, а форма твердого тела постоянна, если только оно не деформируется достаточно сильной внешней силой. (Таким образом, твердые тела не похожи на жидкости, частицы которых притягиваются друг к другу немного меньше, потому что частицы жидкости расположены немного дальше друг от друга, чем частицы в соответствующей твердой форме того же вещества.) В твердом теле частицы остаются в относительно фиксированных положениях, но продолжают колебаться. Вибрирующие частицы в твердом теле не прекращают движение полностью и могут медленно перемещаться в любые пустоты, существующие внутри твердого тела.
частицы в твердую форму.В точке замерзания частицы плотно упакованы вместе и имеют тенденцию блокировать движение друг друга. Притяжения между частицами плотно удерживают частицы вместе, так что весь ансамбль частиц принимает фиксированную форму. Объем твердого тела постоянен, а форма твердого тела постоянна, если только оно не деформируется достаточно сильной внешней силой. (Таким образом, твердые тела не похожи на жидкости, частицы которых притягиваются друг к другу немного меньше, потому что частицы жидкости расположены немного дальше друг от друга, чем частицы в соответствующей твердой форме того же вещества.) В твердом теле частицы остаются в относительно фиксированных положениях, но продолжают колебаться. Вибрирующие частицы в твердом теле не прекращают движение полностью и могут медленно перемещаться в любые пустоты, существующие внутри твердого тела.
 Изображение справа — это кубик льда. Он превратился из жидкости в твердое тело в результате поглощения энергии из более теплой окружающей среды.
Изображение справа — это кубик льда. Он превратился из жидкости в твердое тело в результате поглощения энергии из более теплой окружающей среды.Жидкости
Когда температура образца повышается выше точки плавления твердого вещества, этот образец может находиться в жидком состоянии вещества. Частицы в жидком состоянии расположены гораздо ближе друг к другу, чем частицы в газообразном состоянии, и все же имеют притяжение друг к другу, что очевидно, когда образуются капли жидкости. В этом состоянии слабые силы притяжения в жидкости неспособны удерживать частицы в массу определенной формы. Таким образом, форма жидкости принимает форму любого конкретного контейнера, в котором она находится.Жидкость имеет определенный объем, но не определенную форму. По сравнению с газообразным состоянием свобода движения частиц в жидком состоянии меньше, поскольку движущиеся частицы часто сталкиваются друг с другом и скользят и скользят друг по другу в результате сил притяжения, которые все еще существуют между частицами, и неплотно удерживайте частицы жидкости вместе. При данной температуре объем жидкости постоянен, и его объем обычно незначительно изменяется при изменении температуры.
При данной температуре объем жидкости постоянен, и его объем обычно незначительно изменяется при изменении температуры.
Газы
В газовой фазе материя не имеет фиксированного объема или формы. Это происходит потому, что молекулы широко разделены, а промежутки между частицами обычно примерно в десять раз дальше друг от друга во всех трех пространственных направлениях, что делает газ примерно в 1000 раз менее плотным, чем соответствующая жидкая фаза при той же температуре.(Фаза — это однородная часть вещества.) При повышении температуры газа частицы отделяются друг от друга и движутся с большей скоростью. Частицы в газе движутся довольно случайным и независимым образом, отскакивая друг от друга и от стенок контейнера. Находясь на таком большом расстоянии друг от друга, частицы реального газа слабо притягиваются друг к другу, так что газ не имеет возможности иметь собственную форму. Чрезвычайно слабые силы, действующие между частицами в газе, и большее пространство для движения частиц приводят к почти независимому движению движущихся сталкивающихся частиц.Частицы свободно перемещаются внутри любого контейнера, в который они помещены, заполняя весь его объем, в результате чего стороны контейнера определяют форму и объем газа. Если контейнер имеет отверстие, частицы, движущиеся в направлении отверстия, улетучатся, в результате чего газ в целом будет медленно вытекать из контейнера.
Чрезвычайно слабые силы, действующие между частицами в газе, и большее пространство для движения частиц приводят к почти независимому движению движущихся сталкивающихся частиц.Частицы свободно перемещаются внутри любого контейнера, в который они помещены, заполняя весь его объем, в результате чего стороны контейнера определяют форму и объем газа. Если контейнер имеет отверстие, частицы, движущиеся в направлении отверстия, улетучатся, в результате чего газ в целом будет медленно вытекать из контейнера.
Другие состояния материи
Помимо трех классических состояний материи, есть много других состояний материи, которые обладают характеристиками еще одного из классических состояний материи. Большинство этих состояний материи можно разделить на три категории в зависимости от степени при разной температуре. При комнатной температуре состояния вещества включают жидкий кристалл, аморфное твердое тело и магнитоупорядоченные состояния.При низких температурах состояния вещества включают в себя сверхпроводники, сверхтекучие жидкости и состояние конденсата Бозе-Эйнштейна. При высоких температурах состояния вещества включают плазму и кварк-глюонную плазму. Эти другие состояния вещества обычно не изучаются в общей химии.
Большинство этих состояний материи можно разделить на три категории в зависимости от степени при разной температуре. При комнатной температуре состояния вещества включают жидкий кристалл, аморфное твердое тело и магнитоупорядоченные состояния.При низких температурах состояния вещества включают в себя сверхпроводники, сверхтекучие жидкости и состояние конденсата Бозе-Эйнштейна. При высоких температурах состояния вещества включают плазму и кварк-глюонную плазму. Эти другие состояния вещества обычно не изучаются в общей химии.
Список литературы
- Краколис, Марк и Эдвард Питерс. Вводная химия. 3-е изд. Мейсон, Огайо: Cengage Learning, 2008. .
- Петруччи, Ральф, Харвуд, Уильям, Херринг, Джеффри, Мадура, Джеффри, Общая химия: принципы и современные приложения, 9-е изд.Река Аппер Сэдл, Нью-Джерси: Pearson Prentince Hall, 2007.
- C.N. Херли, W.L. Мастертон, Химия: принципы и реакции , 6-е изд. Brooks / Cole Cengage Learning, Белмонт, Калифорния, 2004 г.

- Cracolice, Mark, Peters, Edward, Введение в химию , 4-е изд. Brooks / Cole Cengage Learning, Белмонт, Калифорния, 2007.
- Zumdahl, Zumdahl, DeCoste, World of Chemistry, Houghton Mifflin Company, Бостон, Массачусетс, 2002.
Авторы и авторство
- Васим Ахмад (UCD), Кайли Бекман (UCD), Фиона Вонг (UCD), Джанет Чжэн (UCD)
Классификация веществ (элементы, соединения, смеси) — Введение в химию
Вещества и смеси
Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ.
ЦЕЛИ ОБУЧЕНИЯ
Отличить химические вещества от смесей
КЛЮЧЕВЫЕ ВХОДЫ
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на исходные компоненты.

- Химическое вещество состоит из одного типа атома или молекулы.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию. Для этого разделения вещество может находиться в одной или двух разных фазах.
Ключевые термины
- смесь : что-то, что состоит из различных, несвязанных элементов или молекул.
- элемент : химическое вещество, которое состоит из определенного типа атомов и не может быть расщеплено или преобразовано с помощью химической реакции.
- вещество : форма вещества с постоянным химическим составом и характерными свойствами.
 Он состоит из одного типа атомов или молекул.
Он состоит из одного типа атомов или молекул.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства.Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми телами, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из атома определенного типа и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, которое состоит из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями.Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями.Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, выделен ли он из реки или изготовлен в лаборатории. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически.Под смесью понимается физическая комбинация двух или более веществ, в которой сохранены идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Кристаллы серы, встречающиеся в природе: Сера встречается в природе в виде элементарной серы, сульфидов и сульфатных минералов, а также в виде сероводорода. Это месторождение полезных ископаемых состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами. Примеры включают:
Примеры включают:
- смеси песка и воды
- смеси песка и железной опилки
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Interactive: Oil and Water : Изучите взаимодействия, вызывающие воду и масло отделить от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб. В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу. На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Классификация веществ (3 части): Введение в классификацию вещества как вещества или смеси веществ.
 Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.
Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.Элементы и Соединения
Элемент — это материал, который состоит из одного типа атомов, а соединение состоит из двух или более типов атомов.
ЦЕЛИ ОБУЧЕНИЯ
Различать элементы и соединения и изучать методы разделения
КЛЮЧЕВЫЕ ВХОДЫ
Ключевые моменты
- Элементы — это простейшие законченные химические вещества.Каждому элементу соответствует отдельная запись в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.

- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно разделить на исходные компоненты.
Ключевые термины
- элемент : Любое одно из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- химическая связь : Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
- соединение : Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, которые находятся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
У каждого атома есть атомный номер, который представляет количество протонов, которые находятся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, обычно встречающиеся в левой части таблицы Менделеева:
- часто проводит электричество
- ковкий
- блестящий
- иногда магнитный.
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, которые можно найти в правой части таблицы Менделеева (справа от лестницы):
- обычно непроводящий
- не податливый
- тусклый (не блестящий)
- немагнитный.
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (последним идентифицированным был ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются на Земле в природе. Элементы, которые не встречаются на Земле в природе, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
было идентифицировано 118 элементов (последним идентифицированным был ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются на Земле в природе. Элементы, которые не встречаются на Земле в природе, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Водород и гелий — безусловно, самые распространенные элементы во Вселенной. Однако железо является наиболее распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% вещества во Вселенной. Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. В темной материи отсутствуют протоны, нейтроны или электроны.
Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. В темной материи отсутствуют протоны, нейтроны или электроны.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. В то время как 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые относительно чистые минералы.Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два отдельных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl). Вода — еще один пример химического соединения. Два или более составляющих элемента соединения можно разделить с помощью химических реакций.
Вода — еще один пример химического соединения. Два или более составляющих элемента соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть:
- молекулярные соединения, удерживаемые вместе ковалентными связями
- солей, удерживаемых ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями.
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, которые содержат только несколько атомов одного элемента, например H 2 или S 8 ).
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
Газовых смесей — Вводная химия — 1-е канадское издание
Цель обучения
- Изучите закон парциальных давлений Далтона.

Одно из свойств газов состоит в том, что они смешиваются друг с другом. Когда они это делают, они превращаются в раствор — гомогенную смесь. Некоторые свойства газовых смесей легко определить, если мы знаем состав газов в смеси.
В газовых смесях каждый компонент газовой фазы можно обрабатывать отдельно. Каждый компонент смеси имеет одинаковую температуру и объем. (Помните, что газы расширяются, заполняя объем своего контейнера; газы в смеси тоже делают это.) Однако у каждого газа свое давление. Парциальное давление газа P i — это давление, которое имеет отдельный газ в смеси. Парциальные давления выражаются в торр, миллиметрах ртутного столба или атмосферах, как и любое другое давление газа; однако мы используем термин давление , когда говорим о чистых газах, и термин парциальное давление , когда говорим об отдельных компонентах газа в смеси.
Закон парциальных давлений Дальтона гласит, что полное давление газовой смеси, P — , равно сумме парциальных давлений компонентов, P i :
Хотя это может показаться тривиальным законом, он усиливает идею о том, что газы ведут себя независимо друг от друга.
Пример 15
В контейнере находится смесь H 2 при 2,33 атм и N 2 при 0,77 атм. Какое полное давление в баллоне?
Решение
Закон парциальных давлений Дальтона гласит, что полное давление равно сумме парциальных давлений. Мы просто складываем два давления вместе:
P общ = 2,33 атм + 0,77 атм = 3,10 атм
Проверьте себя
Воздух можно рассматривать как смесь N 2 и O 2 .В 760 торр воздуха парциальное давление N 2 составляет 608 торр. Какое парциальное давление O 2 ?
Ответ
152 торр
Пример 16
Контейнер 2,00 л с 2,50 атм H 2 соединен с контейнером 5,00 л с 1,90 атм O 2 внутри. Емкости открываются, и газы смешиваются. Какое конечное давление внутри контейнеров?
Решение
Поскольку газы действуют независимо друг от друга, мы можем определить результирующее конечное давление, используя закон Бойля, а затем сложить два результирующих давления вместе, чтобы получить конечное давление. Общий конечный объем составляет 2,00 л + 5,00 л = 7,00 л. Во-первых, мы используем закон Бойля для определения конечного давления H 2 :
Общий конечный объем составляет 2,00 л + 5,00 л = 7,00 л. Во-первых, мы используем закон Бойля для определения конечного давления H 2 :
(2,50 атм) (2,00 л) = P 2 (7,00 л)
Решая для P 2 , получаем
P 2 = 0,714 атм = парциальное давление H 2
Теперь проделаем то же самое для O 2 :
(1,90 атм) (5,00 л) = P 2 (7.00 л)
P 2 = 1,36 атм = парциальное давление O 2
Общее давление — это сумма двух результирующих парциальных давлений:
P общ = 0,714 атм + 1,36 атм = 2,07 атм
Проверьте себя
Если 0,75 атм He в контейнере 2,00 л соединить с контейнером 3,00 л с 0,35 атм Ne, и соединение между контейнерами открыто, каково результирующее полное давление?
Ответ
0.51 атм
Одна из причин, по которой нам приходится иметь дело с законом парциальных давлений Дальтона, заключается в том, что газы часто собираются путем пропускания через воду. Как мы увидим в главе 10 «Твердые тела и жидкости», жидкости постоянно испаряются в пар, пока пар не достигнет парциального давления, характерного для вещества и температуры. Это парциальное давление называется давлением пара. В таблице 6.2 «Давление водяного пара в зависимости от температуры» приведены значения давления пара H 2 O в зависимости от температуры.Обратите внимание, что если вещество обычно является газом при заданном наборе условий, используется термин парциальное давление ; термин давление пара зарезервирован для парциального давления пара, когда жидкость является нормальной фазой при заданном наборе условий.
Как мы увидим в главе 10 «Твердые тела и жидкости», жидкости постоянно испаряются в пар, пока пар не достигнет парциального давления, характерного для вещества и температуры. Это парциальное давление называется давлением пара. В таблице 6.2 «Давление водяного пара в зависимости от температуры» приведены значения давления пара H 2 O в зависимости от температуры.Обратите внимание, что если вещество обычно является газом при заданном наборе условий, используется термин парциальное давление ; термин давление пара зарезервирован для парциального давления пара, когда жидкость является нормальной фазой при заданном наборе условий.
Таблица 6.2 Зависимость давления водяного пара от температуры
| Температура (° C) | Давление пара (торр) | Температура (° C) | Давление пара (торр) | |
|---|---|---|---|---|
| 5 | 6. 54 54 | 30 | 31,84 | |
| 10 | 9,21 | 35 | 42,20 | |
| 15 | 12,79 | 40 | 55,36 | |
| 20 | 17,54 | 50 | 92,59 | |
| 21 | 18,66 | 60 | 149,5 | |
| 22 | 19,84 | 70 | 233,8 | |
| 23 | 21.08 | 80 | 355,3 | |
| 24 | 22,39 | 90 | 525,9 | |
| 25 | 23,77 | 100 | 760,0 |
Каждый раз, когда газ собирается над водой, общее давление равно парциальному давлению газа плюс давлению пара воды. Это означает, что количество собранного газа будет меньше, чем предполагает общее давление.
Это означает, что количество собранного газа будет меньше, чем предполагает общее давление.
Пример 17
Газообразный водород образуется в результате реакции азотной кислоты и элементарного железа.Газ собирается в перевернутом контейнере на 2,00 л, погруженном в бассейн с водой при температуре 22 ° C. В конце сбора парциальное давление внутри емкости составляет 733 торр. Сколько молей газа H 2 было образовано?
Решение
Необходимо учесть, что в полное давление входит давление пара воды. Согласно Таблице 6.2 «Давление водяного пара в зависимости от температуры», давление пара воды при 22 ° C составляет 19,84 торр. Согласно закону парциальных давлений Дальтона, полное давление равно сумме давлений отдельных газов, поэтому
733 торр = PH 2 + PH 2 O = PH 2 + 19.84 торр
Решаем вычитанием:
PH 2 = 713 торр
Теперь мы можем использовать закон идеального газа, чтобы определить количество молей (не забудьте преобразовать температуру в градусы Кельвина, чтобы получилось 295 K):
Отменяются все единицы, кроме мол, который мы ищем. Итак
Итак
n = 0,0775 моль H 2 собрано
Проверьте себя
CO 2 , образующийся при разложении CaCO 3 , собирается в 3.Контейнер на 50 л над водой. Если температура составляет 50 ° C, а общее давление внутри контейнера составляет 833 торр, сколько молей CO 2 было образовано?
Ответ
0,129 моль
Наконец, мы представляем новый блок, который может быть полезен, особенно для газов. Мольная доля, χ i , представляет собой отношение количества молей компонента i в смеси к общему количеству молей в образце:
(χ — строчная греческая буква хи .) Обратите внимание, что мольная доля составляет , а не в процентах; его значения варьируются от 0 до 1. Например, рассмотрим комбинацию 4,00 г He и 5,0 г Ne. Преобразуя оба в моль, получаем
Общее количество молей — это сумма двух количеств молей:
всего молей = 1,00 моль + 0,025 моль = 1,25 моль
Мольные доли — это просто отношение каждого мольного количества к общему количеству моль, 1,25 моль:
Сумма мольных долей равна 1.
Для газов существует другой способ определения мольной доли. Когда газы имеют одинаковый объем и температуру (как в смеси газов), количество молей пропорционально парциальному давлению, поэтому мольные доли для газовой смеси можно определить, взяв отношение парциального давления к общему давлению. :
Это выражение позволяет нам определять мольные доли без прямого вычисления молей каждого компонента.
Пример 18
В контейнере находится смесь He при 0.80 атм и Ne при 0,60 атм. Какова мольная доля каждого компонента?
Решение
Согласно закону Дальтона полное давление складывается из парциальных давлений:
P tot = 0,80 атм + 0,60 атм = 1,40 атм
Мольные доли — это отношение парциального давления каждого компонента к общему давлению:
Опять же, сумма мольных долей равна 1.
Проверьте себя
Какие мольные доли при 0.65 атм O 2 и 1,30 атм N 2 смешаны в контейнере?
Ответ
χO 2 = 0,33; χN 2 = 0,67
Приложение «Еда и напитки: газированные напитки»
Газированные напитки — газированные напитки, пиво, игристые вина — имеют одну общую черту: в них растворен газ CO 2 в таких количествах, которые влияют на восприятие напитка. Большинство людей находят пьянство приятным — действительно, только в Соединенных Штатах — более 1.5 × 10 9 галлон содовой потребляется каждый год, что составляет почти 50 галлонов на человека! Эта цифра не включает другие виды газированных напитков, поэтому общее потребление, вероятно, значительно выше.
Большинство людей находят пьянство приятным — действительно, только в Соединенных Штатах — более 1.5 × 10 9 галлон содовой потребляется каждый год, что составляет почти 50 галлонов на человека! Эта цифра не включает другие виды газированных напитков, поэтому общее потребление, вероятно, значительно выше.
Все газированные напитки готовятся одним из двух способов. Сначала плоский напиток подвергается воздействию высокого давления газа CO 2 , которое заставляет газ растворяться. Затем газированный напиток упаковывают в плотно закрывающуюся упаковку (обычно бутылку или банку) и продают.Когда контейнер открывается, давление CO 2 сбрасывается, в результате чего из раствора выходит хорошо известное шипение , и пузырьки CO 2 выходят из раствора (Рисунок 6.5 (Открытие газированного напитка). Внимание: если CO 2 выходит слишком сильно, может произойти беспорядок!
Рисунок 6.5 Открытие газированного напитка
Если вы не будете осторожно открывать контейнер с газированным напитком, вы можете испортить дело, поскольку из раствора внезапно выйдет CO2.
 Источник: «Откупорка шампанского» Нильса Нордхука под лицензией Creative Commons Attribution-Share Alike 3.0 Unported.
Источник: «Откупорка шампанского» Нильса Нордхука под лицензией Creative Commons Attribution-Share Alike 3.0 Unported.Второй способ газирования напитка — это употребление сахара дрожжами, которые затем генерируют CO 2 в качестве продукта пищеварения. Этот процесс называется ферментацией . Общая реакция —
C 6 H 12 O 6 (вод.) → 2 C 2 H 5 OH (водн.) + 2 CO 2 (вод.)
Когда этот процесс происходит в закрытом контейнере, образующийся CO 2 растворяется в жидкости и высвобождается из раствора только при открытии контейнера.Таким образом превращаются в газированные напитки самые изысканные игристые вина и шампанское. Менее дорогие игристые вина, такие как газированные напитки и пиво, производятся с использованием высокого давления газа CO 2 .
Основные выводы
- Давление газа в газовой смеси называется парциальным давлением .

- Закон парциального давления Дальтона гласит, что полное давление в газовой смеси является суммой отдельных парциальных давлений.
- При улавливании газов над водой необходимо учитывать давление водяного пара.
- Молярная доля — это еще один способ выразить количество компонентов в смеси.
Упражнения
Каково полное давление газовой смеси, содержащей эти парциальные давления: PN 2 = 0,78 атм, PH 2 = 0,33 атм и PO 2 = 1,59 атм?
Каково полное давление газовой смеси, содержащей эти парциальные давления: P Ne = 312 торр, P He = 799 торр и P Ar = 831 торр?
В газовой смеси He и Ne полное давление составляет 335 торр, а парциальное давление He равно 0.228 атм. Какое парциальное давление Ne?
В газовой смеси O 2 и N 2 полное давление составляет 2,66 атм, а парциальное давление O 2 составляет 888 торр.
 Какое парциальное давление у N 2 ?
Какое парциальное давление у N 2 ?Контейнер на 3,55 л содержит смесь 56,7 г Ar и 33,9 г He при 33 ° C. Каковы парциальные давления газов и полное давление внутри контейнера?
Контейнер на 772 мл содержит смесь 2.99 г H 2 и 44,2 г Xe при 388 K. Каковы парциальные давления газов и общее давление внутри контейнера?
Образец O 2 собирают над водой в контейнер объемом 5,00 л при 20 ° C. Если полное давление составляет 688 торр, сколько молей O 2 собирается?
Образец H 2 собирают над водой в емкость 3,55 л при 50 ° C. Если полное давление составляет 445 торр, сколько молей H 2 собирается?
Проба CO отбирается над водой в 25.Контейнер 00 л при 5 ° C. Если общее давление составляет 0,112 атм, сколько молей CO собирается?
Пробу NO 2 собирают над водой в контейнер емкостью 775 мл при 25 ° C.
 Если общее давление составляет 0,990 атм, сколько молей NO 2 собирается?
Если общее давление составляет 0,990 атм, сколько молей NO 2 собирается?Пробу NO собирают над водой в контейнер емкостью 75,0 мл при 25 ° C. Если общее давление составляет 0,495 атм, сколько граммов NO собирается?
Образец ClO 2 собирают над водой в 0.Емкость 800 л при 15 ° C. Если общее давление составляет 1,002 атм, сколько граммов ClO 2 собирается?
Определите мольные доли каждого компонента при смешивании 44,5 г He с 8,83 г H 2 .
Определите мольные доли каждого компонента при смешивании 9,33 г SO 2 с 13,29 г SO 3 .
В контейнере 4,56 атм F 2 сочетается с 2.66 атм Cl 2 . Какова мольная доля каждого компонента?
В контейнере 77,3 атм SiF 4 смешаны с 33,9 атм O 2 . Какова мольная доля каждого компонента?
ответы
1.
2,70 атм
3.
162 торр, или 0,213 атм
5.
P Ar = 10,0 атм; P He = 59.9 атм; P до = 69,9 атм
7.
0,183 моль
9.
0,113 моль
11.
0,0440 г
13.
χHe = 0,718; χh3 = 0,282
15.
χF2 = 0,632; χCl3 = 0,368
Свойства газовой смеси
Смеси газов широко используются во многих областях. Самый распространенный пример — влажный воздух, состоящий в основном из азота, кислорода и водяного пара.Другой пример — газообразные продукты сгорания с азотом, водяным паром и диоксидом углерода.
Особое внимание следует уделять газовым смесям при использовании закона идеального газа, вычислении массы, индивидуальной газовой постоянной или плотности.
Закон идеального газа для газовой смеси
Закон идеального газа для идеального или идеального газа, адаптированного для газовой смеси:
p V = m m R m T (1)
, где
p = абсолютное давление в смеси (Н / м 2 , фунт / фут 2 )
V = объем смеси (м 3 , футов 3 )
м м = масса смеси (кг, фунты)
R м = индивидуальная газовая постоянная для смеси (Дж / кг K, фут фунт / патроны o R)
T = абсолютная температура в смеси ( o K, o R)
Масса газовой смеси
Масса газовой смеси можно выразить как:
900 02 м м = м 1 + м 2 +.. + m n (2)где
m 1 + m 2 + .
. + m n = масса каждого газового компонента в смесь
Индивидуальная газовая постоянная газовой смеси
Индивидуальная газовая постоянная газовой смеси может быть рассчитана как:
R м = (R 1 м 1 + R 2 м 2 +.. + R n m n ) / (m 1 + m 2 + .. + m n ) (3)
Плотность газа Смесь
Плотность газовой смеси можно рассчитать как:
ρ м = (ρ 1 v 1 + ρ 2 v 2 + .. + ρ n v n ) / (v 1 + v 2 +.. + v n ) (4)
где
ρ м = плотность газовой смеси (кг / м 3 , фунт / фут 3 )
ρ 1 .

 Наличие вредоносных микроорганизмов, негативно сказывается на микроклимате помещения, а также способствует разрушению отделочных материалов использованных для декорирования основания.
Наличие вредоносных микроорганизмов, негативно сказывается на микроклимате помещения, а также способствует разрушению отделочных материалов использованных для декорирования основания. Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение.
Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение. Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.  Морская вода — это однородная смесь или раствор.
Морская вода — это однородная смесь или раствор.


 Он состоит из одного типа атомов или молекул.
Он состоит из одного типа атомов или молекул.

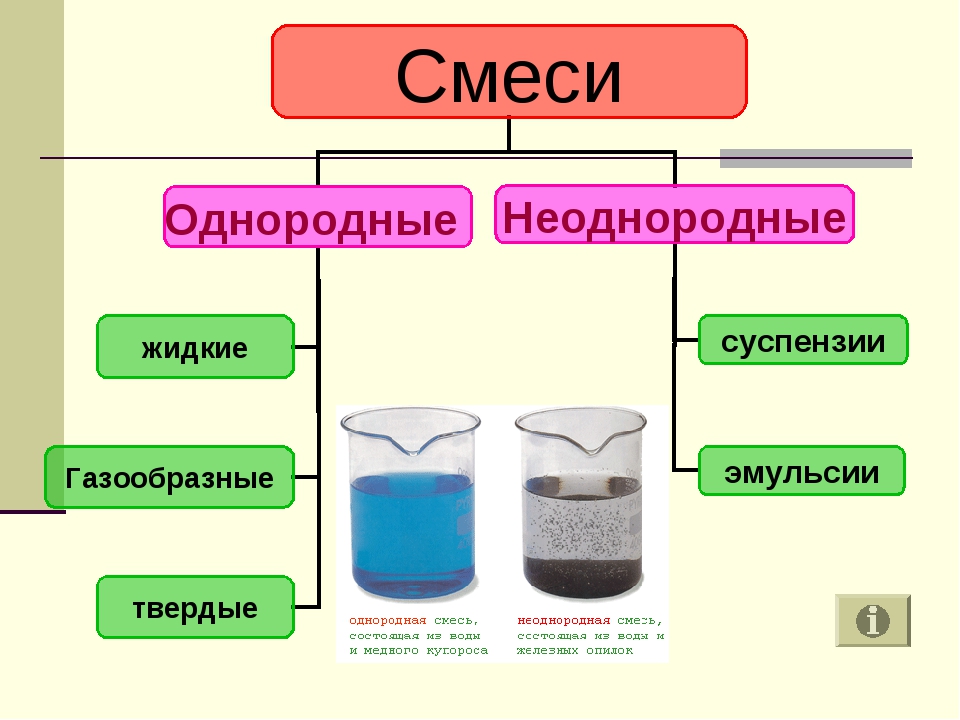
 Какое парциальное давление у N 2 ?
Какое парциальное давление у N 2 ? Если общее давление составляет 0,990 атм, сколько молей NO 2 собирается?
Если общее давление составляет 0,990 атм, сколько молей NO 2 собирается? . + m n = масса каждого газового компонента в смесь
. + m n = масса каждого газового компонента в смесь 