НихромПродукция Описание Цены Стандарты Статьи Фото ФехральПродукция Описание Цены Стандарты Статьи Фото Нихром в изоляцииПродукция Цены Стандарты Статьи Фото ТитанПродукция Описание Цены Стандарты Статьи Фото ВольфрамПродукция Описание Цены Стандарты Статьи Фото МолибденПродукция Описание Цены Стандарты Статьи Фото КобальтПродукция Описание Цены Стандарты Статьи Фото Термопарная проволокаПродукция Описание Цены Стандарты Статьи Фото Провода термопарныеПродукция Цены Стандарты Статьи Фото НикельПродукция Описание Цены Стандарты Статьи Фото МонельПродукцияОписание Цены Стандарты Статьи Фото КонстантанПродукция Описание Цены Стандарты Статьи Фото МельхиорПродукция Описание Цены Стандарты Статьи Фото Твердые сплавыПродукция Описание Цены Стандарты Статьи Фото Порошки металловПродукция Цены Стандарты Статьи Фото Нержавеющая стальПродукция Описание Цены Стандарты Статьи Фото Жаропрочные сплавыПродукция Описание Цены Стандарты Статьи Фото ФерросплавыПродукция Описание Цены Стандарты Статьи Фото ОловоПродукция Описание Цены Стандарты Статьи Фото ТанталПродукция Описание Цены Стандарты Статьи Фото НиобийПродукция Описание Цены Стандарты СтатьиФото ВанадийПродукция Описание Цены Стандарты Статьи Фото ХромПродукция Описание Цены Стандарты Статьи Фото РенийПродукция Описание Цены Стандарты Статьи Фото Прецизионные сплавыПродукция Описание Магнитомягкие Магнитотвердые С заданным ТКЛР С заданной упругостью С высоким эл. Сверхпроводники Термобиметаллы
Основные сведения о нихроме Х20Н80, его заменителях и фехрали Основные сведения о нихроме Х20Н80, его заменителях и фехрали Нихром марки Х20Н80 получил самое широкое распространение среди сплавов аналогичной специализации, особенно в виде нихромовой проволоки. Давайте разберемся, чем вызван нескончаемый спрос на эту марку — это закостенелая привязанность технологов к давно знакомому, привычному, уже расчитанным спиралям, либо за этим стоит нечто большее? Как видно из названия сплава (Х20Н80), он содержит ~20% хрома, ~80% никеля и незначительные примеси, иногда нормализируется
цирконием. Что же нам готовит такое существенное химичеcкое различие в
качественных свойствах этих сплавов. Так как удельное сопротивление железа выше, чем никеля, то и удельное сопротивление сплава, где процент никеля
заменяется железом, будет выше. Более высокое сопротивление позволит нам экономить на количестве применяемого материалла. К тому же и удельный вес
железа меньше, чем у никеля — значит Вы еще дополнительно экономите на весе (от 5% до 7%). Замена дорогостоящего никеля железом позволяет
существенно экономить на материалле. Но не надо забывать и о негативных последствиях этой замены. Фехрали и заменители Х20Н80 гораздо более ломкие нежели нихром, что важно для проволок. Спирали из них можно навивать только в нагретом состоянии — не менее 300°C. Поверхностный окисел, образующийся у сплавов с применением железа, имеет гораздо боллее высокое удельное сопротивление по сравнению с Х20Н80. Это становиться значительной проблемой при применении тонких проволок и лент. Рекристализационный порог ферохромальных сплавов или фехралей находится в районе 600-650°C, существенно ограничивая колличество возможных циклов включения-выключения нагревательных элементов до их разрушения. Можно сказать, что
эти сплавы нашли разную направленность применения в качестве нагревательных эллементов. Фехраль незаменима для достижения температур до
1400°C, Х20Н80 применяется вплоть до 1200°C и имеет температуру плавления равной 1400°C. P.S. Сплав Х20Н80 рекомендуеться применять для нагревателей электротермического оборудования повышенной надежности — ГОСТ 10994-74. «Нихром Х20Н80 против его заменителей и фехрали: плюсы и минусы» Нихром Х20Н80
|
Что такое Нихром? Где применяется, когда и кто изобрел двойной сплав никеля и хрома? :: информационная статья компании Полимернагрев
Век назад в мировой промышленности ничего не было известно о таком сплаве как нихром. Сегодня же без него сложно представить реальность. Нихромовый двухкомпонентный сплав стал известен в широком понимании в 1905 году. Первым человеком, который запатентовал открытие нихрома, является Альберт Лерой Марш. Этот американский ученый имел множество достижений в металлургической сфере деятельности и был признанным высококлассным инженером. Первый нагревательный элемент состоял из 80% никеля и 20% хрома, что и определило его название.
Сегодня же без него сложно представить реальность. Нихромовый двухкомпонентный сплав стал известен в широком понимании в 1905 году. Первым человеком, который запатентовал открытие нихрома, является Альберт Лерой Марш. Этот американский ученый имел множество достижений в металлургической сфере деятельности и был признанным высококлассным инженером. Первый нагревательный элемент состоял из 80% никеля и 20% хрома, что и определило его название.
В Америке, Альберт Марш был признан «Отцом электроотопительной промышленности».
В настоящее время существует около десяти формул. А название нихром служит для всей категории сплавов. В следующих формулах, составленных за последнее столетие, (Ni) никель может составлять 55-78%, а (Cr) хром — 15-23%, 1,5% марганец. В качестве примесей добавляются (Fe) железо, (Zr) цирконий, (Si) кремний, (Mo) молибден, (Ti) титан, (Al) алюминий, а также микродобавки редкоземельных элементов. Основной формулы Марша вышеуказанных лигатур не было.
Качественные характеристики сплава напрямую зависят от соотношений добавленных лигатур к сплаву. Чем больше хрома, тем меньше сплав подвержен окислению становясь хрупким, менее пластичным и низко текучим одновременно. При чрезмерно высоком содержании хрома сплав практически не поддается прокатке и спиральной намотке.
Пластичность сплава и возможность обрабатывания механическими методами — волочения, намотки, сварки дает не только никель, но и железо. Однако высокое содержание (Fe) значительно снижает термические характеристики материала. В результате нихром начинает поддерживать температуру только до 900 ° C, а долговечность сплава в часах заметно снижается.
Сплав с высочайшим содержанием ферума это единственный магнитный вариант нихромового материала обозначаемый маркировкой Х15Н60. В характеристики сплава маркой Х20Н80 не входят магнитные качества.
Отличить сплавы по маркам можно не только с помощью специфических лабораторных исследований, но и за счет дедуктивного способа, применив магнит, подвешенный на нитке. Нихром маркировкой Х15Н60 во всех случаях будет реагировать на магнит слабым притяжением.
Нихром маркировкой Х15Н60 во всех случаях будет реагировать на магнит слабым притяжением.
Нихромовый сплав способен без каких-либо изменений химического и физического строения выдерживать температурные нагрузки до 1400°С. Плотность данного материала равняется 8200-8500 кг/м3. Основой, из-за которой именно этот сплав пользуется высоким спросом в промышленном и бытовом нагреве является его высокое электрическое сопротивление. Значения порядка сопротивления может изменяться зависимо от марки материала. Немаловажным фактором высокого спроса на нихром также считается его высокая коррозийная устойчивость и жаростойкость. Нихром относится к крипоустойчивым материалам, что обозначает его удлинение в определенных условиях, а именно при высокотемпературном нагревании. Но, несмотря на это сплав с легкостью удерживает изначально заданную форму и подает температуры до 1300°С включительно без всяких проблем.
Главным недостатком описываемого материала является ограничение живучести в часах. Кратко говоря, резистивный элемент маркировкой Х20Н80 прослужит значительно больше, чем Х15Н60 в одних и тех же условиях с учетом полностью аналогичных режимах работы.
Кратко говоря, резистивный элемент маркировкой Х20Н80 прослужит значительно больше, чем Х15Н60 в одних и тех же условиях с учетом полностью аналогичных режимах работы.
Что касается проволоки из фехраля, то этот аналог на любителя. Стоимость его значительно ниже, т. к. в составе нет дорогостоящего никелевого материала. В состав входят алюминий, хром и железо. Хрупкость высокая. Температуры нагрева не превышают предел 950 °С. Промышленные предприятия не часто прибегают к использованию данного сплава с целью длительных высокотемпературных обработок.
На рынке все чаще можно встретить нихром нового поколения. Но, точных данных по поводу, каких-либо значительных улучшений в рабочем процессе данного материала пока встречать не пришлось. Поэтому не будет углубляться в соответствие заявляемых характеристик материала нового поколения и того, что есть на самом деле не будем. Пока рано что-то утверждать.
Проволока, лента, нить из нихрома – неотъемлемые части практически всех нагревательных приборов.
В быту нихром стали использовать для утюгов, чуть позже, в пищевой промышленности. Электрические плиты, обогреватели, бойлеры, тостеры, автомобильный прикуриватель, подогрев сидений, полы с подогревом, электронные Атомазеры.
В промышленной среде нихром востребован для производства нагревательных элементов в высокотемпературных электропечах, различных электрических агрегатов теплового воздействия на абсолютно все производственные машины и перерабатываемые материалы. Его применяют в качестве нагревательного и резисторного элемента. Жаропрочный, жаростойкий, кислотостойкий и химически устойчивый сплав способен на высоком уровне выполнять поставленные задачи в определенных агрессивных средах. В агрегатах, реостатах работающих при высоких температурных режимах, в разработке резисторов прецизионных, для которых разработаны специальные марки нихромовых сплавов. В качестве основного жаропрочного покрытия при газотермическом напылении.
Естественно, как и всему дорогому, ученые стараются найти удешевленную, но достойную замену. Но, пока этого не случилось и еще неизвестно осуществиться ли это в ближайшие годы.
История возникновения сплава нихром
Поджарка тостов самый быстрый и вкусный завтрак именно это и стало толчком для возникновения такого высококлассного нагревательного элемента как нихром.
Именно аппарат для приготовления тостов и стал первым электроприбором, который упростил и разнообразил быт многих людей. К данному открытию пришел американский ученый, металлург из штата Иллинойс. Альберт Лерой Марш, впервые разработал и запатентовал в 1906 году двойной сплав, который назвал хромелем. Сегодня этот материал называют нихромом. Четыре части никеля и одна часть хрома — таким был секрет первого достаточно прочного резистивного нагревателя. Хромель ныне нихром наконец-то позволил в полной мере извлечь бытовую выгоду из стремительно развивающихся электросетей и проложил дорогу первым бытовым нагревательным приборам, кухонным плитам, утюгам, чайникам и т. д.
д.
Сегодня без нихрома сложно представить бытовые электроприборы и промышленные процессы. Благодаря Лерою Маршу мы имеем возможность использовать много оборудования облегчающего нашу жизнь.
Нихром, кантал, фехраль, Kantal A-1, A, D, Nichrome 60, Nicrome 80: сводная таблица сопротивления Ом/м погонный в зависимости от диаметра проволоки. Нихром имеет в целом ме́ньшее удельное сопротивление, что позволяет снизить массу спирали, а следовательно, инертность. У кантала менее выражен пружинный эффект, из-за чего из него немного удобнее делать спирали. Так же, у кантала при обжиге образуется тонкий слой оксидной пленки, что позволяет использовать его в генезисах и в микрокоилах. Kanthal A-1 содержит 5.8% алюминия Все марки кантала содержат от 20.5% до 23.5% хрома, оставшиеся 70% — 75% это железо.
| ||||||||
Книга. Руководство по материалам электротехники ч.3
Руководство по материалам электротехники ч.3
?
LiveJournal- Main
- Ratings
- Interesting
- iOS & Android
- Disable ads
- Login
- CREATE BLOG Join
- English
(en)
- English (en)
- Русский (ru)
- Українська (uk)
- Français (fr)
- Português (pt)
- español (es)
- Deutsch (de)
- Italiano (it)
- Беларуская (be)
Удельный вес нихрома, его свойства, преимущества, таблица значений
Нихром представляет собой группу сплавов, состоящего из процентного соотношения никеля, в размере от 55 до 78 процентов, хрома, в размере от 15 до 23 процентов и различных добавок, таких как кремний, алюминий, марганец и железо. Основным предназначением данного элемента является создание нагревательных элементов и резисторов.
Основным предназначением данного элемента является создание нагревательных элементов и резисторов.
Впервые сплав из нихрома был разработан в 1905 году в Соединенных штатах Америки А.Маршем.
Таблица удельного веса нихрома
Так как, нихром является сложным материалом, рассчитать его удельный вес в полевых условиях самостоятельно не представляется возможным. Эти вычисления проводят в специальных химических лабораториях. Однако, при этом средний удельный вес нихрома известен и составляет диапазон от 8,1 до 8.4 г/см3.
Для упрощения подсчетов ниже представлена таблица с значениями удельного веса нихрома, а также такого показателя, как вес нихрома в зависимости от единиц исчисления.
| Материал | Удельный вес (г/см3) | Вес 1 м3 (кг) |
| Нихром | От 8,1 до 8,4 | От 8100 до 8400 |
Свойства нихрома
Благодаря своим отличительным свойствам, таким как высокая стойкость к коррозии, большая пластичность, высокое удельное сопротивление и приемлемой оптимальной рабочей температуре, его часто используют в производстве нагревательных элементов.
Нихром, в зависимости от марки, имеет удельное сопротивление электричеству от 1,05 до 1,4 Ом*мм2/м, обладает плотностью от 8200 до 8500 кг/м3. Температура плавления нихрома составляет диапазон от 1100 до 1400 градусов Цельсия. Оптимальный диапазон рабочих температур – от 1100 до 1400 градусов Цельсия. Удельная теплоемкость при 25 градусов Цельсия составляет 450 Дж/(кг*К). Предел прочности при процессе растяжения от 0,65 до 0,70 ГПа.
Данный вид материалов обладает отличной жаростойкостью, пластичностью, крипоустойчивостью и отлично держит форму.
Преимущества нихрома
Нихром является дорогостоящей группой сплавов. В поисках экономии его часто заменяют аналогом – фехралем. Однако, последний не всегда в полной мере способен заменить нихром, поэтому их применение часто зависит от направления работ.
Нихром обладает такими преимуществами:
Несмотря на то что этот материала дорогой, его надежность и долговечность еще долгое время будет обеспечивать высокую потребность в этом виде сплавов.
Применение нихрома
Применение нихрома обширно, особенно в сферах, где надежность и долговечность цениться больше всего. Из основных направлений стоит выделить:
Расчет электрического сопротивления нихрома Х20Н80
Расчет электрического сопротивления нихрома Х20Н80
Как рассчитать электрическое сопротивление нихромовой ленты и проволоки марки Х20Н80
Наиболее важная характеристика сплава нихром – электрическое сопротивление.
Есть определенная формула для расчета активного сопротивления. Выглядит она вот так:
Выглядит она вот так:
R = (ρ • l )/ S
- R — активное электрическое сопротивление (Ом),
- ρ — удельное электрическое сопротивление (Ом•мм),
- l — длина проводника (м),
- S — площадь сечения (мм2)
Площадь сечения, если кто забыл, рассчитывается по формуле:
S = ᴨ • r2= (ᴨ /4)• d2
ᴨ=3.14159
d — диаметр проволоки
Вы можете сами рассчитать сопротивление нихрома, просто подставив необходимые значения в формулу, или взять уже готовые значения из таблиц ниже.
В первой таблице, представлены значения для наиболее распространенные размеров проволоки нихром Х20Н80. Длина рассчитаной проволоки — 1 м.
| Диаметр, мм | Электрическое сопротивление нихрома (теория), Ом |
| Ø 0,1 | 137,00 |
| Ø 0,2 | 34,60 |
| Ø 0,3 | 15,71 |
| Ø 0,4 | 8,75 |
| Ø 0,5 | 5,60 |
| Ø 0,6 | 3,93 |
| Ø 0,7 | 2,89 |
| Ø 0,8 | 2,2 |
| Ø 0,9 | 1,70 |
| Ø 1,0 | 1,40 |
| Ø 1,2 | 0,97 |
| Ø 1,5 | 0,62 |
| Ø 2,0 | 0,35 |
| Ø 2,2 | 0,31 |
| Ø 2,5 | 0,22 |
| Ø 3,0 | 0,16 |
| Ø 3,5 | 0,11 |
| Ø 4,0 | 0,087 |
| Ø 4,5 | 0,069 |
| Ø 5,0 | 0,056 |
| Ø 5,5 | 0,046 |
| Ø 6,0 | 0,039 |
| Ø 6,5 | 0,0333 |
| Ø 7,0 | 0,029 |
| Ø 7,5 | 0,025 |
| Ø 8,0 | 0,022 |
| Ø 8,5 | 0,019 |
| Ø 9,0 | 0,017 |
| Ø 10,0 | 0,014 |
В таблице представлены значения для наиболее распространенные размеров ленты нихром Х20Н80 длиной 1м.
| Размер, Толщина X ширина, мм | Площадь, мм2 | Электрическое сопротивление нихрома, Ом |
| 0,1×20 | 2 | 0,55 |
| 0,2×60 | 12 | 0,092 |
| 0,3×2 | 0,6 | 1,833 |
| 0,3×250 | 75 | 0,015 |
| 0,3×400 | 120 | 0,009 |
| 0,5×6 | 3 | 0,367 |
| 0,5×8 | 4 | 0,275 |
| 1,0×6 | 6 | 0,183 |
| 1,0×10 | 10 | 0,11 |
| 1,5×10 | 15 | 0,073 |
| 1,0×15 | 15 | 0,073 |
| 1,5×15 | 22,5 | 0,049 |
| 1,0×20 | 20 | 0,055 |
| 1,2×20 | 24 | 0,046 |
| 2,0×20 | 40 | 0,028 |
| 2,0×25 | 50 | 0,022 |
| 2,0×40 | 80 | 0,014 |
| 2,5×20 | 50 | 0,022 |
| 3,0×20 | 60 | 0,018 |
| 3,0×30 | 90 | 0,012 |
| 3,0×40 | 120 | 0,009 |
| 3,2×40 | 128 | 0,009 |
Никель-хромовые сплавы
Химическая формула
Сплавы Ni / Cr
Рассматриваемые темы
Предпосылки
Стойкость к окислению
Нагревательные элементы
Термопары
Высокотемпературные коррозионно-стойкие фоновые сплавы
Сплавы Износостойкие Система хрома показывает, что хром вполне растворяется в никеле. Это максимум составляет 47% при температуре эвтектики и снижается до примерно 30% при комнатной температуре.На основе этого твердого раствора основан ряд коммерческих никель-хромовых сплавов. Такие никель-хромовые сплавы обладают превосходной стойкостью к высокотемпературному окислению и коррозии и хорошей износостойкостью.
Это максимум составляет 47% при температуре эвтектики и снижается до примерно 30% при комнатной температуре.На основе этого твердого раствора основан ряд коммерческих никель-хромовых сплавов. Такие никель-хромовые сплавы обладают превосходной стойкостью к высокотемпературному окислению и коррозии и хорошей износостойкостью. Стойкость к окислению
Введение небольших количеств (<7%) хрома в никель увеличивает чувствительность никель-хромового сплава к окислению. Это потому, что скорость диффузии кислорода в чешуе увеличивается. Эта тенденция меняется на противоположную после того, как уровни добавления хрома превышают 7%, и повышается до уровня добавления примерно 30%.Выше этого уровня мало изменений.
Устойчивость к окислению может быть объяснена образованием прочной защитной накипи. Сцепление и согласованность накипи можно улучшить путем добавления небольших количеств других реактивных элементов, таких как цирконий, кремний, церий, кальций или подобных. Образовавшаяся таким образом окалина представляет собой смесь оксидов никеля и хрома (NiO и Cr 2 O 3 ). Они объединяются с образованием хромита никеля (NiCr 2 O 4 ), который имеет структуру типа шпинели.
Они объединяются с образованием хромита никеля (NiCr 2 O 4 ), который имеет структуру типа шпинели.
Нагревательные элементы
При увеличении добавок хрома наблюдается заметное увеличение удельного электрического сопротивления. Уровень добавления 20% хрома считается оптимальным для проводов с электрическим сопротивлением, подходящих для нагревательных элементов. Этот состав сочетает в себе хорошие электрические свойства с хорошей прочностью и пластичностью, что делает его пригодным для волочения проволоки. Коммерческие марки включают никель-хром-никель-хром и BrightRay. В эту композицию могут быть внесены небольшие изменения, чтобы оптимизировать ее для конкретных приложений.
Рис. 1. Зависимость удельного электрического сопротивления от содержания хрома для никель-хромовых сплавов
Добавление соответствующих реактивных легирующих элементов повлияет на свойства шкалы. Условия эксплуатации сплава во многом будут влиять на состав, который следует использовать. В таблице 1 представлены различия в составе сплавов, используемых для периодического и непрерывного использования.
Условия эксплуатации сплава во многом будут влиять на состав, который следует использовать. В таблице 1 представлены различия в составе сплавов, используемых для периодического и непрерывного использования.
Таблица 1. Подходящие составы для нагревательных элементов, используемых периодически и непрерывно.
Элемент Прерывистый Непрерывный Cr 20 20 Si 1,5 0,5 Ca 0,1 0,05 Ce 0,05 — Ni Весы Весы
Хотя изменения состава оказывают незначительное влияние на механические свойства, более высокие добавки реактивных элементов, как правило, предотвращают отслаивание окалины во время циклической обработки. отопление и охлаждение.Этот эффект менее важен для постоянно работающих нагревательных элементов, поэтому уровни добавления не должны быть такими высокими.
Бинарный сплав 90/10 Ni / Cr также используется для нагревательных элементов и имеет максимальную рабочую температуру 1100 ° C. Другое использование этого сплава — термопары.
Термопары
Термопары: Никель-хромовый сплав 90/10 обычно используется в термопарах в сочетании со сплавом 95/5 Ni / Al. Эта комбинация называется хромель-алюмель и, как и нагревательные элементы, имеет максимальную рабочую температуру 1100 ° C.Эта пара становится подверженной дрейфу около 1000 ° C из-за преимущественного окисления после длительного использования. Было обнаружено, что добавление кремния преодолевает этот эффект. Коммерческие марки включают Nicrosil (содержащий 14% Cr и 1,5% Si) и Nisil (содержащий 4,5% Si и 0,1% Mg).
Высокотемпературные коррозионно-стойкие сплавы
Никель-хромовый сплав 80/20 часто используется для деформируемых и литых деталей для высокотемпературных применений, так как он имеет лучшую стойкость к окислению и горячей коррозии по сравнению с более дешевыми сплавами железо-никель-хром. Этот хромоникелевый сплав хорошо подходит для применений, подверженных окислению.
Этот хромоникелевый сплав хорошо подходит для применений, подверженных окислению.
Для применений, где встречаются топливная зола и / или отложения, такие как соли щелочных металлов, такие как сульфаты, более подходят сплавы с более высоким содержанием хрома. Это связано с тем, что зола топлива вступает в реакцию с оксидной окалиной. Зола, содержащая ванадий, особенно агрессивна в этом отношении и оказывает флюсирующее действие на окалину, увеличивая восприимчивость сплава к окислению.
В серосодержащих средах предпочтительно образуется сульфид хрома (Cr 2 S 3 , точка плавления 1550 ° C), чем сульфид никеля.Образование сульфида никеля является предпочтительным, поскольку это препятствует образованию эвтектики никель / сульфид никеля, которая имеет низкую температуру плавления. В конце концов, местные запасы хрома могут быть исчерпаны, и сера будет реагировать с никелем с образованием эвтектического соединения с низкой температурой плавления, что приведет к атаке жидкой фазы. Сплавы, подвергшиеся этой форме поражения, имеют на поверхности бородавки. Из-за преимущественного образования сульфидов хрома следует, что никель-хромовые сплавы с более высоким содержанием хрома более устойчивы к этому типу атак.
Сплавы, подвергшиеся этой форме поражения, имеют на поверхности бородавки. Из-за преимущественного образования сульфидов хрома следует, что никель-хромовые сплавы с более высоким содержанием хрома более устойчивы к этому типу атак.
Сплавы никель / хром, содержащие более 30% хрома, имеют двухфазную структуру, состоящую из α-хрома и γ-никеля. Фаза a-хрома является хрупкой, и, следовательно, пластичность сплава снижается с увеличением содержания хрома. Свойства некоторых бинарных сплавов приведены в таблице 2. Добавление около 1,5% ниобия приводит к повышению прочности и пластичности, в то же время уменьшая охрупчивание после высокотемпературного воздействия при условии контроля примесей, таких как углерод, азот и кремний.
Таблица 2. Свойства прочности на растяжение и пластичность для некоторых хромоникелевых сплавов при комнатной температуре.
Содержание Cr (%) Прочность при растяжении (МПа) Удлиненное. (%)
(%) 35 480 62 50 540-680 7-24 60 800-1000 1-2
Сплавы с содержанием хрома примерно до 35% подходят для горячей обработки.Выше этого уровня они обычно подходят только для кастинга. Некоторого увеличения пластичности можно добиться, добавив цирконий или титан. Инконель 671, (содержащий 48% Cr и 0,35% Ti, является таким сплавом и используется в таких областях, как дуплексные трубы для труб для перегрева угля.
Износостойкие сплавы
Механизмы износа сложные, но высокая твердость и хорошая коррозионная стойкость способствуют хорошей износостойкости.Хромоникелевые сплавы представляют собой экономичную альтернативу таким материалам, как наплавленные кобальто-хромовые сплавы с добавками углерода и вольфрама, которые обычно используются в износостойких областях.Примером никель-хромового сплава для этого типа применения является 8-12% Cr, 0,3-1,0% C, 3-4% Si, 1,5-2,5% B, 1-4% Fe и остальное Ni. Покрытие из этого материала, нанесенного методом дуги в защитной среде инертного газа, будет иметь диапазон 40-50 Роквелла C.
Покрытие из этого материала, нанесенного методом дуги в защитной среде инертного газа, будет иметь диапазон 40-50 Роквелла C.
Таблица свойств никель-хромовых сплавов
Материал Никель-хромовые сплавы Состав: Ni / 14-46Cr + некоторая комбинация Fe Mo Cu Co Si Ti W Al + другие
Свойство Минимальное значение (S.I.) Максимальное значение (SI) Единицы (SI) Минимальное значение (Imp.) Максимальное значение (Imp.) Единицы (Imp.) Атомный объем (средний) 0,0065 0,0072 м 3 / кмоль 396,654 439,371 дюйм 3 / кмоль Плотность 7,75 8,65 Мг / м 8,65 Мг / м 540. 002
002 фунт / фут 3 Энергосодержание 40 200 МДж / кг 4333,55 21667,7 ккал / фунт Модуль объемной упругости 110 205 ГПа 15,9541 29,7327 10 6 фунтов / кв. Дюйм Прочность на сжатие 170 2100 МПа 24,6564 304.579 тысяч фунтов / кв. Дюйм Пластичность 0,005 0,7 0,005 0,7 Предел упругости 170 2100 МПа 24,6564 304,579 Предел выносливости 130 1150 МПа 18,8549 166,793 тысяч фунтов / кв. Дюйм Вязкость разрушения 65 150 МПа. м 1/2
м 1/2 59,153 136,507 тыс. фунтов / кв. дюйм 1/2 Твердость 1000 6000 МПа 145.038 870,227 тыс. фунтов / кв. дюйм Потери Коэффициент 9e-005 0,0013 9e-005 0,0013 Модуль разрыва 170 2100 МПа 24.6564 304,579 тысяч фунтов / кв. Дюйм Коэффициент Пуассона 0,26 0,325 0,26 0,325 Модуль сдвига 55 100 ГПа 7 10 6 psi Прочность на растяжение 330 2300 МПа 47,8625 333,587 тысяч фунтов на квадратный дюйм Модуль Юнга 150 245 ГПа7557 35,5342 10 6 psi Температура стекла K ° F Скрытая теплота плавления 275 320 кДж / кг 118,228 137,575 БТЕ / фунт Максимальная рабочая температура 1070 1473 K 1466,33 2191. 73
73 ° F Точка плавления 1475 1710 K 2195,33 2618,33 ° F Минимальная рабочая температура 0 0 K -459,67 -459,67 ° F Удельная теплоемкость 380 500 Дж / кг К 0,294066 0,386929 БТЕ / фунт F Теплопроводность 8 17 Вт / м.K 14,9763 31,8246 BTU.ft / h.ft 2 .F Тепловое расширение 9 16 10 -6 / K 16,2 28,8 10 -6 / ° F Потенциал пробоя МВ / м В / мил Диэлектрическая проницаемость Удельное сопротивление 84 240 10 -8 Ом. м
м 84 240 10 -8 Ом.м
Экологические свойства Факторы сопротивления 1 = Плохо 5 = Отлично Горючесть 5 Пресная вода 5 Органические растворители 5 Окисление при 500 ° C 5 Морская вода 5 Сильная кислота 5 Сильные щелочи 5 УФ 5 Износ 5 Слабые кислоты 5 Слабые щелочи 5
Первичные автор: AZoM.com NiChrome: Эта группа материалов на твердом растворе никель / хром. Эти материалы обладают отличной стойкостью к окислению, износостойкостью и высокотемпературными свойствами. Типичное применение — нагревательные элементы, термопары и другие приложения, связанные с высокой температурой воды и коррозией.
Типичное применение — нагревательные элементы, термопары и другие приложения, связанные с высокой температурой воды и коррозией. Выбор нихромовой проволоки и трансформатора
Я рекомендую вам прочитать информацию о трансформаторе
(Понимание трансформаторов), чтобы вы лучше понимали трансформаторы, если вы не
знаком с ними.На странице «Дизайн источника питания» объясняется, как построить полный блок питания.
поставка для устройства для резки пенопласта с горячей проволокой после выбора проволоки и трансформатора.
На этой странице собрана информация о том, как выбрать оба
нихромовая проволока и трансформатор для блока питания, потому что они идут вместе — один
зависит от другого.
Измерение проводов
Проволока измеряется калибром. Есть несколько
различные стандарты манометров, поэтому обычно используется десятичное измерение вместо манометра
сейчас же. Для нихромовой проволоки и других цветных металлов используется американский стандарт калибра AWG.
Калибр проводов, и это стандарт, который я использую на своем веб-сайте, но я также указываю десятичный
дюймов. AWG такой же, как у стандарта B&S, Brown и Sharp. Этот стандарт также используется для
медный и алюминиевый провод такого же калибра, какой используется для электропроводки в вашем доме.
Есть несколько
различные стандарты манометров, поэтому обычно используется десятичное измерение вместо манометра
сейчас же. Для нихромовой проволоки и других цветных металлов используется американский стандарт калибра AWG.
Калибр проводов, и это стандарт, который я использую на своем веб-сайте, но я также указываю десятичный
дюймов. AWG такой же, как у стандарта B&S, Brown и Sharp. Этот стандарт также используется для
медный и алюминиевый провод такого же калибра, какой используется для электропроводки в вашем доме.
Проволока из черных металлов, такая как железо и проволока из нержавеющей стали
обычно используют калибр проволоки W&M, Washburn & Moen.
Сравнительная таблица размеров проводов различного калибра
стандарты и дополнительную информацию о калибрах проводов и их происхождении можно найти здесь:
http://www. sizes.com/materls/wire.htm.
Еще одна полезная сравнительная таблица, содержащая десятичный эквивалент, а не размер шкалы, как
выше можно найти здесь:
http: // www.dave-cushman.net/elect/wiregauge.html.
sizes.com/materls/wire.htm.
Еще одна полезная сравнительная таблица, содержащая десятичный эквивалент, а не размер шкалы, как
выше можно найти здесь:
http: // www.dave-cushman.net/elect/wiregauge.html.
Чем больше калибр, тем больше размер провода.
меньше. Калибр AWG 40 хорош, а калибр AWG 14 почти такой же, как
домашняя проволочная вешалка для одежды.
Какой размер провода мне использовать?
Вы можете использовать проволоку любого диаметра. Пена может
be и режется проволокой диаметром от 40 (0,003 дюйма) до 11 (.091 »
диам.). Самый распространенный размер — 26 калибра. Короткий кусок проволоки калибра 40 был
используется с батареей 9 В для резки очень тонких (0,020 дюйма) и узких полосок пенопласта для
прогулочные планеры для воздушного серфинга. Две батареи типа D могут привести в действие 4-дюймовый кусок нихромового провода 32-го калибра в маленькой руке.
прошел резак для пены.
Две батареи типа D могут привести в действие 4-дюймовый кусок нихромового провода 32-го калибра в маленькой руке.
прошел резак для пены.
Блок питания на 12 В питает до 24 дюймов 26
калибр проволоки. Это будет включать почти все настольные резаки для пенопласта, которые являются наиболее
обычный тип резака для пенопласта, и будет включать небольшие резаки для лука.Вот почему 26 калибра
самый распространенный. Размеры от 24 до 30 также используются для настольных моделей.
калибр от 16 до 11 используется для резки пенопласта
формы, такие как лепка, потому что они достаточно жесткие, чтобы держать форму, а не
Прямо. 12-дюймовый кусок нихромовой проволоки 14 калибра требует всего 1,9 вольт, но почти 12 вольт.
усилители. Проволока большего диаметра также используется для очень длинных фрез, например 8 или 10 футов.
Фактор натяжения
Все металлы расширяются при нагревании, поэтому нихромовая проволока
температура резки также увеличивается и увеличивается.Из-за этого какой-то метод
Для резки пенопласта необходимо поддерживать натяжение проволоки. Обычно это
выполняется либо с помощью пружинящей рамы, между которой протягивается проволока, либо с помощью пружины.
используемый. Также возможно использование груза с тросом над шкивом.
Натяжение проволоки также помогает удерживать ее, поэтому при небольшом давлении
режущая пена, проволока остается достаточно прямой, что необходимо для хорошего качества и
равномерный крой.
Из-за необходимости натяжения проволока
То есть, меньшее натяжение может быть применено без разрыва или постоянного растяжения проволоки.
Использование проволоки 40 калибра означает, что возможно очень небольшое натяжение, и будет труднее сохранить
Проволока насмехается при резке. Чем длиннее проволока, тем большее давление нужно приложить
к проволоке, чтобы она оставалась прямой и насмехалась. Вот почему, как правило,
чем длиннее проволока, тем она должна быть толще. Не существует стандарта длины и калибра
поскольку теоретически можно использовать любой размер на любой длине при соответствующем напряжении и
текущая мощность источника питания.
Чем длиннее проволока, тем большее давление нужно приложить
к проволоке, чтобы она оставалась прямой и насмехалась. Вот почему, как правило,
чем длиннее проволока, тем она должна быть толще. Не существует стандарта длины и калибра
поскольку теоретически можно использовать любой размер на любой длине при соответствующем напряжении и
текущая мощность источника питания.
Зависимость датчика / тока / температуры
Температура прямого провода при комнатной температуре
спокойный воздух можно рассчитать. Заданная температура приведет к определенному току
протекает через проволоку определенного диаметра.Неважно, какой длины будет провод,
данный ток, протекающий через провод, приведет к той же температуре. За
Например, провод 26 калибра с протекающим через него 2,1 А приведет к температуре 600 градусов по Фаренгейту. будь то длина 2 дюйма или длина 200 дюймов.
будь то длина 2 дюйма или длина 200 дюймов.
Чем больше диаметр, тем больше требуется тока
нагреть до той же температуры. Например, только 0,31 ампера приведет к 600F в 40
калибр провода, но 11.Для провода 14 калибра требуется 6 ампер. Кроме того, чем больше
диаметр проволоки, тем больше времени потребуется для достижения равновесной температуры.
Равновесная температура.
Причина, по которой прямой провод достигает заданной температуры
и остается там в спокойном воздухе комнатной температуры, так что течение продолжает производить больше
тепло, пока течет ток. В то же время тепло отводится
от проволоки до окружающего воздуха.Чем горячее проволока, тем быстрее нагревается
переведен прочь. Проволока достигает равновесной температуры, когда выделяемое тепло
равно теплу, переданному прочь.
Если свернуть провод в тугую катушку, как в нагревателях,
передача тепла от проволоки уменьшается, поскольку в данном объеме проволоки больше
воздуха, и проволока станет горячее.
Таким же образом провод контактирует с любым другим
Материал изменит скорость передачи тепла от проволоки.Если материал это
находится в контакте с хорошим проводником тепла, таким как медь, равновесная температура
будет ниже, потому что тепло отводится быстрее. Если материал в
контакт с плохим проводником тепла (изолятором) равновесная температура будет
выше, потому что отводится меньше тепла. Эти ситуации приводят к сложным
уравнения теплопередачи, которые нелегко решить. В этом случае экспериментирование
Требуется найти правильный провод и напряжение для создания желаемой температуры.
При использовании в печах, печах и
в закрытых отапливаемых областях провод сопротивления будет становиться все горячее по мере того, как
печь или печь нагреваются, если не изменять напряжение. В
равновесная температура основана на температуре окружающего воздуха и
будет довольно постоянная РАЗНИЦА температуры между проводом и
температура воздуха. Итак, если вы начали с 28 футов 22 калибра
проволока, которая была намотана таким образом, чтобы температура была вдвое выше, чем у
прямой провод, это будет около 1200F (316C), разница в 1130F
между температурой воздуха и провода, если температура воздуха в корпусе
стартовал на 70F.Если бы провод при этом просто покраснел бы
температура. Когда вы достигнете 1400F (760C) воздух в помещении
температура, температура провода будет 1400F плюс разница
1130F или 2530F. Проволока расплавится . Для печей и
прочие высокотемпературные оболочки, калибр, тип, длина, катушка проводов
размеры и приложенное напряжение должны быть тщательно спроектированы, чтобы ограничить
температура проволоки при конечной достигнутой температуре воздуха должна быть хорошей
ниже точки плавления, и аппарат должен быть рассчитан на отключение
при целевой температуре или ниже.
В
равновесная температура основана на температуре окружающего воздуха и
будет довольно постоянная РАЗНИЦА температуры между проводом и
температура воздуха. Итак, если вы начали с 28 футов 22 калибра
проволока, которая была намотана таким образом, чтобы температура была вдвое выше, чем у
прямой провод, это будет около 1200F (316C), разница в 1130F
между температурой воздуха и провода, если температура воздуха в корпусе
стартовал на 70F.Если бы провод при этом просто покраснел бы
температура. Когда вы достигнете 1400F (760C) воздух в помещении
температура, температура провода будет 1400F плюс разница
1130F или 2530F. Проволока расплавится . Для печей и
прочие высокотемпературные оболочки, калибр, тип, длина, катушка проводов
размеры и приложенное напряжение должны быть тщательно спроектированы, чтобы ограничить
температура проволоки при конечной достигнутой температуре воздуха должна быть хорошей
ниже точки плавления, и аппарат должен быть рассчитан на отключение
при целевой температуре или ниже. Это нетривиальный дизайн
процесс и обычно должен быть предоставлен инженеру, обученному теплотехнике
перевод и электротехническое проектирование.
Это нетривиальный дизайн
процесс и обычно должен быть предоставлен инженеру, обученному теплотехнике
перевод и электротехническое проектирование.
Ток, создаваемый приложенным напряжением
Как упоминалось выше, не имеет значения, какой длины
проволоки, определенный ток, протекающий через проволоку заданного диаметра, приведет к заданному
температура на открытом воздухе. Так как же создается этот ток? Приложенное напряжение
через два конца провода создают этот ток.Чем длиннее провод, тем больше
напряжение требуется для создания такого же тока. Это связано с разницей в
общее сопротивление провода разной длины.
Закон Ома
Закон Ом необходим для определения силы тока и
напряжение отношения. Закон об омах гласит:
В = ИК
V — это напряжение в вольтах (традиционный E используется для
напряжение и означает электродвижущую силу вместо V), I — ток в амперах, а R —
сопротивление в Ом.Вы можете переставить формулу, чтобы найти текущий:
I = V / R
Из этого видно, что сопротивление растет,
так же требуется напряжение, чтобы получить такой же ток. Сопротивление нихромовой проволоки
указывается в омах на фут. Чем длиннее провод, тем большее сопротивление он имеет.
чем длиннее провод, тем большее напряжение требуется для проталкивания тока через сопротивление
провода.
Какой трансформатор мне нужен?
Мощность рассчитывается по формуле:
W = I 2 R или W
= VI
Трансформатор обычно измеряется в ваттах или вольт-амперах.
Для небольших трансформаторов они по сути одинаковы и взаимозаменяемы. Вам нужно
знать мощность, необходимую для нагреваемого провода, чтобы знать, какого размера будет трансформатор
требуется.Чтобы рассчитать это, вы сначала решаете, какой калибр вы будете использовать, и найдете
сопротивление этого провода в омах на фут. Например, провод 26 калибра имеет сопротивление
2,67 Ом на фут. Если вы используете проволоку для резки пенопласта, нормальный
желаемая температура 600F. Чтобы обеспечить некоторую гибкость в температуре, цифра 800F
(вы всегда можете выключить его, если у вас есть источник переменного напряжения). Вам также необходимо
знать длину провода. Допустим, вы будете использовать 2 фута.Теперь вы можете рассчитать
сопротивление, напряжение и требования к мощности.
I = 2,6 ампер (из температурной таблицы)
r = 2,67 Ом
R = RL = 2,67 X 2 = 5,34 Ом
В = IR = 2,6 X 5,34 = 13,9 В
P = VI = 13,9 X 2,6 = 36,1 Вт
I = ток в амперах
r = сопротивление на фут провода в Ом
R = общее сопротивление провода
L = длина провода в футах
P = мощность в ваттах
Значит, вам нужен трансформатор, способный потушить хотя бы
2.6 ампер с номинальной мощностью 36 Вт или более при выходном напряжении 13,9 В или более. В
самое близкое, что вы можете найти с таким напряжением или выше, — 24 вольт. Вы можете использовать диммер, чтобы
уменьшите напряжение (см. страницу с описанием блока питания). Вам нужно 2,6 ампера, чтобы вы
Чтобы получить мощность в ваттах, необходимо умножить требуемые амперы на выходное напряжение, 2,6 X
24 = 62,4 Вт или вольт-ампер. Ближайший к 62,4 Вт и более — 24 Вт.
выходное напряжение, трансформатор 100 Вт.
Вы решили, что это слишком много, и хотите использовать 50
трансформатор ватт. Что ты можешь сделать? Понизить напряжение? Нет, это будет
снизить температуру. Сделать провод короче? Может быть. Помните, что текущий
требуется одинаково независимо от длины провода, и данный трансформатор ограничен
определенное количество тока, протекающего по его обмоткам, независимо от напряжения. В
мощность трансформатора ограничена его способностью передавать тепло.Жара
измеряется в ваттах и определяется током и сопротивлением, поэтому, если ничего не изменится,
Вт остается прежним. Если вы снизите первичное напряжение на трансформаторе,
выходное напряжение также падает, но сопротивление обмоток не меняется, поэтому
максимальный ток тоже не меняется. Укорочение провода не меняет
текущее требование, но меняет требование напряжения.
Как выясняется, требование напряжения для 18 дюймов
нихромовая проволока при 800F — 10.4 вольта, поэтому вместо выходного трансформатора 24 вольт, 12 вольт
выходная мощность, можно использовать трансформатор мощностью 50 Вт. Текущая мощность составляет 50/12 = 4,1 ампер,
значительно выше требуемых 2,6 ампер. Трансформатор на 12 В и 50 Вт имеет более тяжелую
обмотки, чем выход 24 В, поэтому он может выдерживать удвоенный ток, но весь трансформатор
намного меньше 100-ваттного трансформатора.
Трансформаторы — калибр и максимальная длина
Ниже приведены несколько примеров из
27
трансформеры ношу сейчас.Увидеть
страница трансформатора, где каждый трансформатор имеет свой график. На графиках показана минимальная и максимальная длина каждого
трансформатор нагревается до 800F при использовании с диммером для резки пенопласта. Для пластика
При изгибе проволока должна быть более горячей и поэтому максимальная длина будет короче. В
нормальная температура резки пены составляет 600F, но расчет на 800F дает некоторое пространство для
регулировка. Все, кроме одного, выходы с двойным напряжением, поэтому более низкое напряжение обрабатывается более высоким.
ток и, таким образом, расширяет диапазон до проводов большего диаметра, потому что допустимая сила тока
удваивается, когда напряжение уменьшается вдвое.Чем выше напряжение, тем меньше калибр, но больше
провод. Диммеры не доводят до нуля вольт, они идут примерно до 20%, так что есть
минимальная длина провода, которую можно использовать.
Этот трансформатор можно использовать с
короткие отрезки более жесткой проволоки для фигурной резки.
Этот трансформатор подходит большинству
настольные резаки для поролона и средние луки с использованием нихромовой проволоки марки
24-26.
Обозначение химических соединений и написание химических формул
Хотя существует много тысяч разных
химических соединений существует очень определенная система номенклатуры, посредством которой мы
может назвать или написать химические формулы для большинства соединений. Мы делим
соединения на два основных типа бинарных соединений и тройных соединений.
Бинарные соединения
Все настоящие бинарные соединения содержат только два элемента.В
имя каждые двоичное соединение заканчивается на ide . Двоичный
соединения бывают трех типов. Их:
Тип I …………. металл образует только один
тип катиона
Тип II ………… металл образует две или
другие виды катионов
Тип III ………. содержит только неметаллы
Мы рассмотрим каждый тип по отдельности.
Тип I, двоичный
Соединения
Для бинарных соединений типа I присутствующий металл может быть
находится либо в Группа 1 или Группа 2 на периодическом
Таблица.Система наименования этого типа соединений довольно проста и понятна.
находится ниже.
Правила наименования бинарных соединений типа I
1. Катион всегда называют первым, а анион — вторым.
2. Простой катион (полученный из одного атома) получил свое название от
имя элемента.
3. Простой анион (полученный из одного атома) называется, взяв
первая часть имени элемента (корень) и добавление букв IDE.
4. Напишите название соединения, объединив названия
ионы.
Примеры:
Назовите соединение RbI.
Rb — это химический символ рубидия .
I — химический символ йода, корень которого — йод. Добавить
Яд заканчивается, чтобы получить йодид .
Соедините части, чтобы получить название йодид рубидия .
Назовите соединение CaO.
Ca — химический символ кальция .
О — символ кислорода, корень которого — бык. Добавить ide
окончание получить оксид .
Соедините кусочки вместе, чтобы получить оксид кальция .
Назовите соединение Li 3 N.
Li — это химический символ лития .
N — химический символ азота, корень которого — nitr. Добавить
окончание ide, чтобы получить нитрид .
Соедините части, чтобы получить название нитрида лития .
Напишите формулу сульфида калия.
Химический символ калия — K . К находится на улице 1 столбец периодической таблицы, следовательно, его степень окисления +1.
Сульфид получают из серы, обозначенной символом S . это
степень окисления -2.
+1 -2
Пока у нас есть K S.
Общий положительный заряд должен уравновешивать общий отрицательный
плата. Следовательно, нам нужно 2 К атомов, чтобы получить общий положительный заряд +2.
Это уравновешивает заряд серы -2.
Собирая все вместе, получаем K 2 S .
Напишите формулу хлорида магния.
Химический символ магния — Mg . Mg находится в 2 и столбец периодической таблицы, следовательно, его степень окисления +2.
Хлорид является производным хлора, обозначение которого — Cl .
Его степень окисления -1.
+2 -1
Пока у нас есть Mg Cl
Общий положительный заряд должен уравновешивать общий отрицательный
плата. Следовательно, нам нужно 2 атома хлора, чтобы дать общий отрицательный заряд
-2. Это уравновешивает заряд магния.
Собирая все вместе, мы получаем MgCl 2 .
Дополнительные примеры
NaCl натрия
хлорид
KI калий
йодид
RbBr рубидий
бромид
MgS магний
сульфид
Mg 3 N 2 нитрид магния
Натрия фторид
NaF
оксид стронция
SrO
Бериллий хлорид
BeCl 2
сульфид цезия
CE 2 S
Фосфид калия
К 3 П
Тип II, двоичный
Соединения
Для бинарных соединений типа II присутствует металл НЕ можно найти ни в Группе 1, ни в Группе 2 периодической таблицы.В
Система наименования для этого типа соединений приведена ниже.
Правила наименования бинарных соединений типа II
1. Катион всегда называют первым, а анион — вторым.
2. Простой катион (полученный из одного атома) получил свое название от
имя элемента. Включите римскую цифру, чтобы указать степень окисления.
число (заряд) на катионе металла.
3. Простой анион (полученный из одного атома) называется, взяв
первая часть имени элемента (корень) и добавление букв IDE.
4. Напишите название соединения, объединив названия
ионы.
Римские цифры
1 ………
Я 6 ……… VI
2 ………
II 7……… VII
3 ………
III 8 ……… VIII
4 ………
IV 9 ……… IX
5 ………
В 10 ……. Х
Назовите соединение FeCl 2 .
Fe — химический символ железа.
о
Fe отсутствует в столбце 1 или 2 и ;
поэтому в имени необходима римская цифра.Вернись к этому
в ближайшее время.
Cl — химический символ хлора, корнем которого является хлор.
Добавьте окончание язя, чтобы получить хлорид.
На данный момент у нас хлорид железа (??) .
Чтобы найти римскую цифру
о
Найдите заряд аниона.
Cl имеет заряд -1.
о
Умножьте количество этих атомов, чтобы получить общее
отрицательный заряд.
Есть 2 атома Cl.
2 раза -1 = -2. <--- общий отрицательный заряд.
о
Сбалансируйте общий отрицательный заряд с общим положительным зарядом.
Общий отрицательный заряд -2 должен быть уравновешен общий положительный заряд +2.
о
Разделите общий положительный заряд на количество атомов, чтобы получить
Римская цифра.
Есть только 1 Fe
+2 делится на 1 = +2. Римская цифра — II.
Соедините части, чтобы получить название хлорид железа (II) .
Назовите соединение PbS 2 .
Pb — химический символ свинца.
о
Pb отсутствует в столбце 1 или 2 и ;
поэтому необходима римская цифра.
S — сера, корень которой — сульф. Добавьте окончание ide, чтобы получить
сульфид.
На данный момент у нас есть сульфида свинца (??) .
Чтобы найти римскую цифру
S имеет заряд -2.
Так что есть 2 атома серы. 2 х -2 = -4. <---- всего отрицательный
заряд
Общий положительный заряд должен быть +4.
Есть 1 атом свинца, поэтому +4 1 = +4. Римская цифра — IV.
Соедините части, чтобы получить название сульфид свинца (IV) .
Напишите формулу оксида никеля (III).
Химический символ никеля — Ni . Степень окисления
равно +3, как указано римской цифрой.
Оксид получают из кислорода, обозначение которого — O .это
степень окисления -2.
+3-2
Пока у нас есть Ni O.
Чтобы сбалансировать расходы, мы находим наименее распространенные
кратное (НОК) 3 и 2. НОК равно 6. Нам нужны два атома Ni (+6 +3 = 2)
и три атома O (-6-2 = 3), чтобы сбалансировать заряды.
Собирая все вместе, получаем Ni 2 O 3 .
Напишите формулу нитрида свинца (IV).
Химический символ свинца — Pb . Степень окисления
+4.
Нитрид получают из азота, обозначение которого — N . это
степень окисления -3.
+ 4–3
Пока у нас Pb N.
НОК 4 и 3 равно 12.Нам понадобится три атома Pb (+12 +4 = 3)
и 4 атома N (-12-3 = 4), чтобы сбалансировать заряды.
Собирая все вместе, получаем Pb 3 N 4 .
Напишите название оксида железа (II).
Химический символ железа — Fe . Степень окисления
+2.
Оксид получают из кислорода, обозначение которого — O .это
степень окисления -2.
+2
-2
Пока у нас Fe O
Так как начисления уже сбалансированы, дополнительных работ по
быть сделано.
Собирая все вместе, получаем FeO.
Дополнительные примеры
Fe 2 O 3 Оксид железа (III)
CuCl Медь
(I) хлорид
CuCl 2 Хлорид меди (II)
Свинец PbS (II)
сульфид
ПбС 2 сульфид свинца (IV)
Оксид хрома (VI)
CrO 3
Сульфид кобальта (III)
Co 2 S 3
Никель (II) бромид
NiBr 2
Фосфид ртути (II)
Hg 3 P 2
иодид кадмия (II)
CdI 2
Тип III, двоичный
Соединения
Бинарные соединения типа III не содержат металлов
атомы.Для бинарных соединений типа III существуют две разные системы наименования:
старая система и новая система. Старая система использует префиксы для
указать номер каждого присутствующего атома, и новая система идентична
который используется для обозначения соединений типа II.
Важно отметить, что только одна система может быть
используется одновременно. НИКОГДА не смешивайте префиксы и римские цифры.
Правила наименования бинарных соединений типа III: СТАРАЯ СИСТЕМА
1.Первый элемент в формуле называется первым, а полный
используется имя элемента.
2. Второй элемент назван как анион: root +
ide
3. Префиксы используются для обозначения количества присутствующих атомов. (Увидеть
таблицу ниже)
4. Префикс mono- никогда не используется для наименования первого
элемент.
Префиксы
1………
моно 6 ……… гекса
2 ……… ди
7 ……… гепта
3 ………
три 8 ……… окта
4 ………
тетра 9 ……… нона
5 ………
пента 10 ……. дека
Имя
соединение NO 2 .
N — химический символ азота .Поскольку есть только
один атом азота И это первый элемент, префикс моно не является
используемый.
О — химический символ кислорода, корень которого — бык. Добавить
Яд окончание получить оксид. Есть два атома кислорода, поэтому мы также добавляем префикс di , чтобы получить диоксида.
Соедините части, чтобы получить название диоксид азота .
Назовите соединение N 2 O.
N — химический символ азота . Поскольку есть два
Для атомов азота нам нужно добавить префикс di , чтобы получить диазот.
О — химический символ кислорода, корень которого — бык. Добавить
ide, чтобы получить оксид . Есть только один атом кислорода, к которому мы добавляем
префикс моно (моно IS используется для второго элемента), чтобы получить монооксид .
Соедините части, чтобы получить название оксида азота .
Напишите формулу четыреххлористого углерода.
Химический символ углерода — C . Префикса нет
перед углеродом в химическом названии, следовательно, есть только 1 атом углерода в
химическая формула.
Тетрахлорид имеет префикс тетра , что означает наличие 4 атомов.Хлорид является производным от хлора, символ которого — .
Cl . Таким образом, в химической формуле 4 атома Cl.
Собирая все вместе, получаем CCl 4 .
Напишите формулу пентаоксида динотрогена.
Префикс di означает 2 . Таким образом, в
химическая формула.
Префикс пента означает 5.Таким образом, в
химическая формула.
Собирая все вместе, получаем N 2 O 5 .
Теперь применим новую систему к этим
те же соединения. Для бинарных соединений типа III новая система идентична
это использовалось для обозначения бинарных соединений типа II. Преимущество использования нового
система состоит в том, что вам нужно изучить на одну систему меньше.
Правила наименования бинарных соединений типа III: НОВАЯ СИСТЕМА
1.Катион всегда называют первым, а анион — вторым.
2. Простой катион (полученный из одного атома) получил свое название от
имя элемента. Включите римскую цифру, чтобы указать степень окисления.
число (заряд) на катионе металла.
3. Простой анион (полученный из одного атома) называется, взяв
первая часть имени элемента (корень) и добавление букв IDE.
4.Напишите название соединения, объединив названия
ионы.
Имя
соединение NO 2 .
N — химический символ азота .
о
Азот отсутствует в столбце 1 -й или 2 -й ;
поэтому в имени необходима римская цифра.
О — символ кислорода, корень которого — бык.Добавить ide
окончание, чтобы получить оксид .
На данный момент у нас оксида азота (??) .
Чтобы найти римскую цифру
O имеет заряд -2.
2 атома кислорода умножить на -2 = -4. <---- общий отрицательный заряд.
Общий отрицательный заряд -4 должен быть уравновешен общий положительный заряд +4.
+4, деленное на 1 (один атом N) = +4. Римская цифра — IV.
Соедините части, чтобы получить оксид азота (IV) названия .
Название соединения N 2 O.
N — химический символ азота .
о
Азот отсутствует в столбце 1 -й или 2 -й ;
поэтому в имени необходима римская цифра.
О — символ кислорода, корень которого — бык. Добавить ide
окончание, чтобы получить оксид .
На данный момент у нас оксида азота (??) .
Найти римскую цифру.
O имеет заряд -2.
2 атома кислорода умножить на -2 = -4. <---- общий отрицательный заряд.
Общий положительный заряд должен быть +2.
+2 делить на 2 (2 N атомов) = +1. Римская цифра I.
. Соедините части, чтобы получить оксид азота (I) названия .
Напишите формулу хлорида углерода (IV).
Символ углерода — C . Степень окисления +4, так как
обозначается римской цифрой.
Хлорид получают из хлора.Расход по хлору -1 .
+4 -1
Пока у нас есть C Cl
НОК 4 и 1 равно 4. Нам нужен 1 атом C (+4 +4 = 1) и 4 Cl.
атомов (-4 -1 = 4), чтобы сбалансировать заряды.
Собирая все вместе, получаем CCl 4 .
Напишите формулу оксида азота (V).
Обозначение азота — N . Римская цифра указывает
заряд +5 .
Оксид получают из кислорода. Заряд по кислороду -2 .
+5-2
Пока у нас N O
НОК 5 и 2 равно 10. Следовательно, нам нужно 2 N атомов и 5 O
атомы, чтобы уравновесить заряды.
Собирая все вместе, получаем N 2 O 5 .
Тройные соединения
(A.K.A. Соединения, содержащие многоатомные ионы)
Ион — атом с электрическим зарядом
(положительное или отрицательное).
Многоатомный ион представляет собой группу атомов с
электрический заряд. (Хотя это группа атомов, она действует как
одиночный атом.)
Имена почти
все многоатомные ионы заканчиваются буквами ate или ите . Остерегайтесь трех исключений: цианида, гидроксида и пероксида. Эти ионы
заканчиваться на ide, который может заставить думать, что у вас есть двоичное соединение, когда
у вас фактически есть тройное соединение.
Обозначение тройных соединений
Следуйте
системы наименования для бинарных соединений типа I и типа II, но
НЕ
ИЗМЕНИТЬ НАЗВАНИЕ ПОЛИАТОМНОГО ИОНА .
Примеры
Na 2 SO 4 сульфат натрия
KH 2 PO 4 дигидрофосфат калия
Fe (NO 3 ) 3 нитрат железа (III)
Mn (OH) 2 гидроксид марганца (II)
Na 2 SO 3 сульфит натрия
Гидроксид кальция
Са (ОН) 2
фосфат натрия
Na 3 PO 4
дихромат аммония
(NH 4 ) 2 Cr 2 O 7
перхлорат кобальта (II)
Co (ClO 4 ) 2
Нитрит меди (II)
Cu (НЕТ 2 ) 2
Обозначение многоатомных ионов
содержащие кислород
Есть много атомов, которые образуют несколько
различные многоатомные ионы с кислородом.Система наименования этих ионов:
основан на двух вещах: наиболее распространенном ионе в каждой серии и количестве
атомы кислорода по сравнению с наиболее распространенным ионом. Те, которые нас беспокоят больше всего
представляют собой ионы фосфора, серы, азота, хлора и углерода. запомнить
эти ионы!
PO 4 3- = фосфат
SO 4 2- = сульфат
НЕТ 3 — = нитрат
ClO 3 — = хлорат
CO 3 2- = карбонат
Обозначение многоатомных ионов, содержащих кислород
Один подробнее кислород, самый распространенный…………… per___ate
Мост
обыкновенный ………………………………………… ….. ___ дата
Один меньше кислорода, что наиболее распространено ……………… ___ite
Два менее кислорода, чем наиболее распространенный …………… гипо___ит
Примеры
PO 5 3- = перфосфат
PO 4 3- = фосфат (наиболее распространенный)
PO 3 3- = фосфит
PO 2 3- =
гипофосфит
SO 5 2- = персульфат
СО 4 2- = сульфат (наиболее распространенный)
SO 3 2- = сульфит
SO 2 2- = гипосульфит
Примечание: некоторые из ионов не существуют в
в реальном мире они написаны здесь, чтобы показать, как использовать систему именования.
Обозначение кислот
Для этого класса ВСЕ кислоты начинаются с H
(водород). Названия ВСЕХ кислот заканчиваются словом кислота. Есть два
типы кислот: те, которые содержат кислород, и те, которые не содержат.
Обозначение кислот, НЕ содержащих кислород
1.
Возьмите имя аниона, добавьте префикс hydro и измените
заканчивая на ic .
2.
Добавьте слово кислота .
Назовите соединения HF.
Мы знаем, что это кислота, потому что химическая формула начинается с
H.
Возьмите название аниона (фторид) добавьте приставку гидро и
измените окончание на ic: плавиковый
Наконец, добавьте слово кислота.
плавиковая кислота
Назовите соединение HCN.
Мы знаем, что это кислота, потому что химическая формула начинается с
H.
Кислорода нет, поэтому начнем с приставки hydro.
Далее берем название аниона (цианид) и меняем окончание
по ic: синильная кислота
Наконец, добавьте слово кислота.
синильная кислота
Напишите формулу бромистоводородной кислоты.
Мы знаем, что формула начинается с H , потому что это
кислота. Заряд по водороду +1.
Мы также знаем, что кислота не содержит кислорода из-за
приставка Hydro.
Удаление гидро и ic оставляет нам бром, корень
бром или Br . Заряд брома -1.
+1 -1
Пока у нас
грн. Сбалансируйте заряды, чтобы получить формулу HBr.
Напишите формулу сероводородной кислоты.
Мы знаем, что формула начинается с H , потому что это
кислота. Заряд по водороду +1.
Мы также знаем, что кислота не содержит кислорода из-за
приставка Hydro.
Удаление гидро и ic оставляет нам серу. Заряд
по сере -2.
+1 -2
Пока у нас есть H S
Сравняйте расходы, чтобы получить формулу H 2 S .
Обозначение кислот, в которых содержится кислород
1.
Найдите название многоатомного иона.
2.
Измените ate на ic или ite на ous.
3.
Добавьте слово кислота.
Назовите соединение HClO 4 .
Вы знаете, что это кислота, потому что она начинается с H.
. ClO 4 — — перхлорат-ион.
Смените ate на ic и получите хлорную.
Добавьте слово кислота и получите хлорную кислоту .
Назовите соединение H 2 SO 3 .
Вы знаете, что это кислота, потому что она начинается с H.
. SO 3 2- — это сульфит-ион.
Смените его на ous и получите сернистый.
Добавляем слово кислота и получаем сернистую кислоту .
о
Имя на самом деле сульф ur ous acid, но я буду считать
сернистая кислота правильная, потому что она соответствует системе наименований.
Напишите формулу фосфористой кислоты.
Слово кислота говорит нам, что первым элементом является H.Заряд на H
+1.
Мы также знаем, что это тройная кислота, потому что приставка гидро
(имеется в виду бинарная кислота) отсутствует.
Замените ous на it, чтобы получить фосфит. Формула фосфита
это PO 3 -3 .
Собирая все вместе и уравновешивая расходы, получаем H 3 PO 3 .
Переуступка
Назовите каждое из следующих соединений.
1. MgO
26.Cu (OH) 2
2. ZnBr 2 27. PCl 5
3. Ca (ClO 3 ) 2 28. LiNO 3
4. BaSO 4 29. KH 2 PO 4
5.AgNO 3 30. CuCN
6. H 2 S
31. KHCO 3
7. CaO
32. NaHSO 4
8. H 2 CO 3 33.Li 2 HPO 4
9. Mg 3 (PO 4 ) 2 34. H 3 PO 4
10. К 2 CrO 4 35. MgSO 4
11. NaI
36. Ca (IO 2 ) 2
12.Al (НЕТ 2 ) 3 37. SiO 2
13. ZnSe
38. CuCl
14. Sn (MnO 4 ) 2 39. KClO 4
15. AsCl 5 40.CaSO 3
16. CuSO 3 41. NaBr
17. ВЧ
42. P 2 O 3
18. Fe 2 (SO 4 ) 3 43. HClO
19. Sn (Cr 2 O 7 ) 2 44.№ 2 О 4
20. AsCl 3 45. NaH
21. KCN
46. АЛН
22. NH 4 ОН
47. PbC 2 O 4
23. Fe (ClO 4 ) 3 48.H 2 SE
24. HNO 2 49. H 3 PO 2
25. CS 2 50. CaH 2
Напишите формулы для каждого из следующих соединений.
51. олово (II)
нитрат 76.кальций
бикарбонат
52. цинк (II)
фосфат 77. кальций
гидроксид
53. гипофосфор
кислота 78. бисульфат цинка (II)
54. железо (III)
хлорид 79. серебро (I)
оксид
55. литий
сульфид 80.хлористый
кислота
56. серебро (I)
оксалат 81. свинец (IV)
оксид
57. хлорная
кислота 82. кальций
ацетат
58. калий
перманганат 83. фосфат натрия
59. стронций
гипохлорит 84.оксид меди (I)
60. медь (I)
сульфит 85. фосфор
кислота
61. углерод (IV)
сульфид 86. иодистоводородная кислота
62. кальций
оксид 87. натрий
фторид
63. барий
Карбонат 88.фосфор
(V) оксид
64. сурьма (III)
дихромат 89. бромид серы (II)
65. кремний (IV)
оксид 90. алюминия (III)
сульфат
66. железо (II)
карбонат 91. азот (III)
оксид
67. натрий
цианид 92.алюминий
(III) йодид
68. углерод (IV)
хлорид 93. железо (III)
фосфат
69. цезий
фторид 94. цинк (II)
перхлорат
70. натрий
хромат 95. натрия
дигидрофосфат
71. сероводородный
кислота 96.сернистая кислота
72. алюминий (III)
оксид 97. карбонат стронция
73. аммоний
фосфат 98. медь (II)
гидроксид
74. бор (III)
фторид 99. железо (II)
оксалат
75. радий
сульфат 100.фосфор
(V) сульфид
Калькулятор молярной массы, молекулярной массы и элементного состава
Расчет молярной массы (молярной массы)
Чтобы рассчитать молярную массу химического соединения, введите его формулу и нажмите «Вычислить». В химической формуле вы можете использовать:- Любой химический элемент.Начните с заглавной буквы в химическом символе и используйте нижний регистр для остальных букв: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы: D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- парантез () или скобки [].
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Са (ОН) 2,
К4 [Fe (CN) 6],
CuSO4 * 5h3O,
вода,
азотная кислота,
перманганат калия,
этанол,
фруктоза. Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот.
Расчет молекулярной массы (молекулярной массы)
Для расчета молекулярной массы химического соединения введите его формулу, указав массовое число изотопа после каждого элемента в квадратных скобках.
Примеры расчета молекулярной массы:
C [14] O [16] 2,
S [34] O [16] 2.
Определения молекулярной массы, молекулярной массы, молярной массы и молярной массы
- Молекулярная масса ( молекулярная масса ) — это масса одной молекулы вещества, выраженная в единых атомных единицах массы (u). (1 ед. Равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молярная масса ) — это масса одного моля вещества, выраженная в г / моль.
Вес атомов и изотопов взят из статьи NIST. Расскажите нам о своем опыте работы с калькулятором молекулярной массы.
Связано: Молекулярные массы аминокислот
Молекулярные массы, рассчитанные сегодня
Молекулы, ионы и химические формулы
Глава 1 «Введение в химию» познакомила с некоторыми фундаментальными понятиями химии, уделяя особое внимание основным свойствам атомов и элементов.Эти сущности являются строительными блоками всех веществ, с которыми мы сталкиваемся, однако наиболее распространенные вещества состоят не только из чистых элементов или отдельных атомов. Вместо этого почти все вещества представляют собой химические соединения или смеси химических соединений. Хотя существует всего около 115 элементов (из которых около 86 встречаются в природе), известны миллионы химических соединений с огромным диапазоном физических и химических свойств. Следовательно, акцент современной химии (и этого текста) делается на понимании взаимосвязи между структурами и свойствами химических соединений.
Нефтепереработка. Используя химические вещества, катализаторы, тепло и давление, нефтеперерабатывающий завод будет разделять, объединять и перестраивать структуру и схемы связывания основных молекул углерода и водорода, присутствующих в сырой нефти. Конечные продукты включают бензин, парафин, дизельное топливо, смазочные материалы и битум.
В этой главе вы научитесь описывать состав химических соединений. Мы познакомим вас с химической номенклатурой — языком химии — которая позволит вам распознавать и давать названия наиболее распространенным видам соединений.Понимание химической номенклатуры не только важно для изучения химии, но и имеет другие преимущества — например, помогает понять этикетки на продуктах, которые можно найти в супермаркете и аптеке. Вы также будете лучше подготовлены к пониманию многих важных экологических и медицинских проблем, с которыми сталкивается общество. К концу этой главы вы сможете описать, что происходит с химической точки зрения, когда врач готовит гипс для стабилизации сломанной кости, и вы узнаете состав обычных веществ, таких как отбеливатель для стирки, активный ингредиент в разрыхлителе и дурно пахнущее соединение, отвечающее за запах испорченной рыбы.Наконец, вы сможете объяснить химические различия между разными марками бензина.
2.1 Химические соединения
Цель обучения
- Чтобы понять разницу между ковалентной и ионной связью.
Атомы во всех веществах, содержащих более одного атома, удерживаются вместе за счет электростатических взаимодействий — взаимодействия между электрически заряженными частицами, такими как протоны и электроны.- взаимодействия между электрически заряженными частицами, такими как протоны и электроны. Электростатическое притяжение — электростатическое взаимодействие между противоположно заряженными частицами (положительным и отрицательным), в результате которого возникает сила, заставляющая их двигаться навстречу друг другу. между противоположно заряженными видами (положительными и отрицательными) приводит к возникновению силы, которая заставляет их двигаться друг к другу, как притяжение между противоположными полюсами двух магнитов. Напротив, электростатическое отталкивание — электростатическое взаимодействие между двумя видами, которые имеют одинаковый заряд (как положительный, так и отрицательный), что приводит к силе, заставляющей их отталкивать друг друга.между двумя видами с одинаковым зарядом (как положительными, так и отрицательными) приводит к возникновению силы, которая заставляет их отталкиваться друг от друга, как это делают одни и те же полюса двух магнитов. Атомы образуют химические соединения, когда притягивающие электростатические взаимодействия между ними сильнее, чем отталкивающие. В совокупности мы называем притягивающие взаимодействия между атомами химическими связями, притягивающими взаимодействиями между атомами, которые удерживают их вместе в соединениях.
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные.В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, но они ближе к одной из этих крайностей. Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, которые редко встречаются в чем-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает нам понять, почему вещества, которые имеют разные виды химических связей, имеют очень разные свойства. Ионные соединения Соединение, состоящее из положительно заряженных ионов (катионов) и отрицательно заряженных ионов (анионов), удерживаемых вместе сильными электростатическими силами.состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения — соединение, которое состоит из дискретных молекул. обычно состоят из молекул. Группа атомов, в которой одна или несколько пар электронов являются общими между связанными атомами. Это группы атомов, в которых одна или несколько пар электронов являются общими для связанных атомов. В ковалентной связи — электростатическое притяжение между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют.атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Мы начинаем обсуждение структур и формул с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны в главе 8 «Ионная связь в сравнении с ковалентной связью».
Обратите внимание на узор
Ионные соединения состоят из ионов с противоположными зарядами, удерживаемых вместе сильными электростатическими силами, тогда как пары электронов являются общими для связанных атомов в ковалентных соединениях.
Ковалентные молекулы и соединения
Так же, как атом — это простейшая единица, обладающая фундаментальными химическими свойствами элемента, молекула — это простейшая единица, обладающая фундаментальными химическими свойствами ковалентного соединения. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («два атома») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 (часть (а) на рисунке 2.1 «Элементы, существующие в виде ковалентных молекул»). Точно так же несколько чистых элементов являются многоатомными молекулами, которые содержат более двух атомов. («Много атомов») молекулы , такие как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке 2.1 «Элементы, которые существуют как ковалентные молекулы»).
Каждое ковалентное соединение представлено молекулярной формулой — представлением ковалентного соединения, которое состоит из атомного символа для каждого составляющего элемента (в заданном порядке), сопровождаемого нижним индексом, указывающим количество атомов этого элемента в молекуле.Нижний индекс пишется только в том случае, если число больше 1., что дает атомный символ для каждого составляющего элемента в заданном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс пишется только в том случае, если количество атомов больше 1. Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как H 2 O. Точно так же диоксид углерода, содержащий один атом углерода. и два атома кислорода в каждой молекуле записываются как CO 2 .
Рисунок 2.1 Элементы, которые существуют как ковалентные молекулы
Периодическая таблица элементов и химический состав
Chemicool
Группа 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Период
1 1
H 2
He 2 3
Li 4
Be 5
B 6
С 7
N 8
O 9
Ф 10
Ne 3 11
Na 12
мг 13
Al 14
Si 15
п. 16
S 17
Класс 18
Ар 4 19
К 20
Ca 21
SC 22
Ti 23
В 24
Cr 25
Mn 26
Fe 27
Co 28
Ni 29
Cu 30
Zn 31
Ga 32
Ge 33
Как 34
SE 35
Br 36
Kr 5 37
руб. 38
Sr 39
Y 40
Zr 41
Nb 42
Пн 43
Tc 44
Ру 45
Правый 46
Pd 47
Ag 48
КД 49
В 50
Sn 51
Сб 52
Te 53
I 54
Xe 6 55
CS 56
Ba 57-71
72
Hf 73
Ta 74
Вт 75
Re 76
Ос 77
Ir 78
Pt 79
Au 80
Hg 81
Tl 82
Pb 83
Bi 84
Po 85
При 86
Rn 7 87
Fr 88
Ra 89-103
104
Rf 105
Дб 106
Sg 107
Bh 108
HS 109
млн т 110
DS 111
Rg
.
 Они объединяются с образованием хромита никеля (NiCr 2 O 4 ), который имеет структуру типа шпинели.
Они объединяются с образованием хромита никеля (NiCr 2 O 4 ), который имеет структуру типа шпинели. Условия эксплуатации сплава во многом будут влиять на состав, который следует использовать. В таблице 1 представлены различия в составе сплавов, используемых для периодического и непрерывного использования.
Условия эксплуатации сплава во многом будут влиять на состав, который следует использовать. В таблице 1 представлены различия в составе сплавов, используемых для периодического и непрерывного использования.
 Этот хромоникелевый сплав хорошо подходит для применений, подверженных окислению.
Этот хромоникелевый сплав хорошо подходит для применений, подверженных окислению. Сплавы, подвергшиеся этой форме поражения, имеют на поверхности бородавки. Из-за преимущественного образования сульфидов хрома следует, что никель-хромовые сплавы с более высоким содержанием хрома более устойчивы к этому типу атак.
Сплавы, подвергшиеся этой форме поражения, имеют на поверхности бородавки. Из-за преимущественного образования сульфидов хрома следует, что никель-хромовые сплавы с более высоким содержанием хрома более устойчивы к этому типу атак. (%)
(%) Покрытие из этого материала, нанесенного методом дуги в защитной среде инертного газа, будет иметь диапазон 40-50 Роквелла C.
Покрытие из этого материала, нанесенного методом дуги в защитной среде инертного газа, будет иметь диапазон 40-50 Роквелла C. 002
002 м 1/2
м 1/2  73
73 м
м Есть несколько
различные стандарты манометров, поэтому обычно используется десятичное измерение вместо манометра
сейчас же. Для нихромовой проволоки и других цветных металлов используется американский стандарт калибра AWG.
Калибр проводов, и это стандарт, который я использую на своем веб-сайте, но я также указываю десятичный
дюймов. AWG такой же, как у стандарта B&S, Brown и Sharp. Этот стандарт также используется для
медный и алюминиевый провод такого же калибра, какой используется для электропроводки в вашем доме.
Есть несколько
различные стандарты манометров, поэтому обычно используется десятичное измерение вместо манометра
сейчас же. Для нихромовой проволоки и других цветных металлов используется американский стандарт калибра AWG.
Калибр проводов, и это стандарт, который я использую на своем веб-сайте, но я также указываю десятичный
дюймов. AWG такой же, как у стандарта B&S, Brown и Sharp. Этот стандарт также используется для
медный и алюминиевый провод такого же калибра, какой используется для электропроводки в вашем доме. sizes.com/materls/wire.htm.
Еще одна полезная сравнительная таблица, содержащая десятичный эквивалент, а не размер шкалы, как
выше можно найти здесь:
http: // www.dave-cushman.net/elect/wiregauge.html.
sizes.com/materls/wire.htm.
Еще одна полезная сравнительная таблица, содержащая десятичный эквивалент, а не размер шкалы, как
выше можно найти здесь:
http: // www.dave-cushman.net/elect/wiregauge.html. Две батареи типа D могут привести в действие 4-дюймовый кусок нихромового провода 32-го калибра в маленькой руке.
прошел резак для пены.
Две батареи типа D могут привести в действие 4-дюймовый кусок нихромового провода 32-го калибра в маленькой руке.
прошел резак для пены.
 Чем длиннее проволока, тем большее давление нужно приложить
к проволоке, чтобы она оставалась прямой и насмехалась. Вот почему, как правило,
чем длиннее проволока, тем она должна быть толще. Не существует стандарта длины и калибра
поскольку теоретически можно использовать любой размер на любой длине при соответствующем напряжении и
текущая мощность источника питания.
Чем длиннее проволока, тем большее давление нужно приложить
к проволоке, чтобы она оставалась прямой и насмехалась. Вот почему, как правило,
чем длиннее проволока, тем она должна быть толще. Не существует стандарта длины и калибра
поскольку теоретически можно использовать любой размер на любой длине при соответствующем напряжении и
текущая мощность источника питания. будь то длина 2 дюйма или длина 200 дюймов.
будь то длина 2 дюйма или длина 200 дюймов.
 В
равновесная температура основана на температуре окружающего воздуха и
будет довольно постоянная РАЗНИЦА температуры между проводом и
температура воздуха. Итак, если вы начали с 28 футов 22 калибра
проволока, которая была намотана таким образом, чтобы температура была вдвое выше, чем у
прямой провод, это будет около 1200F (316C), разница в 1130F
между температурой воздуха и провода, если температура воздуха в корпусе
стартовал на 70F.Если бы провод при этом просто покраснел бы
температура. Когда вы достигнете 1400F (760C) воздух в помещении
температура, температура провода будет 1400F плюс разница
1130F или 2530F. Проволока расплавится . Для печей и
прочие высокотемпературные оболочки, калибр, тип, длина, катушка проводов
размеры и приложенное напряжение должны быть тщательно спроектированы, чтобы ограничить
температура проволоки при конечной достигнутой температуре воздуха должна быть хорошей
ниже точки плавления, и аппарат должен быть рассчитан на отключение
при целевой температуре или ниже.
В
равновесная температура основана на температуре окружающего воздуха и
будет довольно постоянная РАЗНИЦА температуры между проводом и
температура воздуха. Итак, если вы начали с 28 футов 22 калибра
проволока, которая была намотана таким образом, чтобы температура была вдвое выше, чем у
прямой провод, это будет около 1200F (316C), разница в 1130F
между температурой воздуха и провода, если температура воздуха в корпусе
стартовал на 70F.Если бы провод при этом просто покраснел бы
температура. Когда вы достигнете 1400F (760C) воздух в помещении
температура, температура провода будет 1400F плюс разница
1130F или 2530F. Проволока расплавится . Для печей и
прочие высокотемпературные оболочки, калибр, тип, длина, катушка проводов
размеры и приложенное напряжение должны быть тщательно спроектированы, чтобы ограничить
температура проволоки при конечной достигнутой температуре воздуха должна быть хорошей
ниже точки плавления, и аппарат должен быть рассчитан на отключение
при целевой температуре или ниже. Это нетривиальный дизайн
процесс и обычно должен быть предоставлен инженеру, обученному теплотехнике
перевод и электротехническое проектирование.
Это нетривиальный дизайн
процесс и обычно должен быть предоставлен инженеру, обученному теплотехнике
перевод и электротехническое проектирование. Этот трансформатор подходит большинству
настольные резаки для поролона и средние луки с использованием нихромовой проволоки марки
24-26.
Калькулятор молярной массы, молекулярной массы и элементного состава
Расчет молярной массы (молярной массы)Чтобы рассчитать молярную массу химического соединения, введите его формулу и нажмите «Вычислить». В химической формуле вы можете использовать:
Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот. Расчет молекулярной массы (молекулярной массы)Для расчета молекулярной массы химического соединения введите его формулу, указав массовое число изотопа после каждого элемента в квадратных скобках.Примеры расчета молекулярной массы: C [14] O [16] 2, S [34] O [16] 2. Определения молекулярной массы, молекулярной массы, молярной массы и молярной массы
Расскажите нам о своем опыте работы с калькулятором молекулярной массы. Связано: Молекулярные массы аминокислот |
| Молекулярные массы, рассчитанные сегодня |
1
H
He
Li
Be
B
С
N
O
Ф
Ne
Na
мг
Al
Si
п.
S
Класс
Ар
К
Ca
SC
Ti
В
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
Как
SE
Br
Kr
руб.
Sr
Y
Zr
Nb
Пн
Tc
Ру
Правый
Pd
Ag
КД
В
Sn
Сб
Te
I
Xe
CS
Ba
Hf
Ta
Вт
Re
Ос
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
При
Rn
Fr
Ra
Rf
Дб
Sg
Bh
HS
млн т
DS
Rg

 сопротивлением
сопротивлением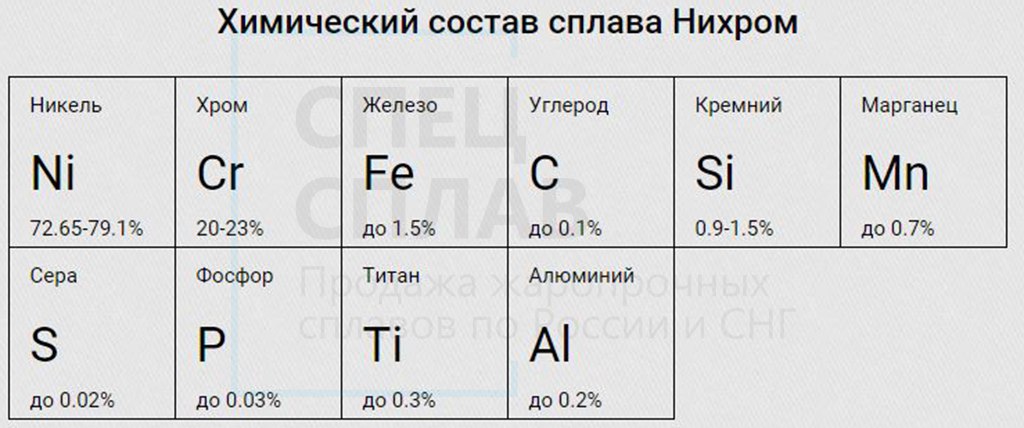

 Фехраль более устойчива в высокоглиноземной
керамике и серосодержащей атмосфере, чем нихромовая проволока и лента. Замена никеля на железо означает сокращение возможных циклов включений-выключений при преодолении
барьера в 600°C. Никель от того и дорог, что его невозможно заменить железом. Это относиться ко всем нихромам и фехралям без
исключения. Частое желание заказчика съэкономить на исходном материале оборачивается серьезными затратами при частой замене нагревательных
элементов, работающих вне своих технологических режимов.
Фехраль более устойчива в высокоглиноземной
керамике и серосодержащей атмосфере, чем нихромовая проволока и лента. Замена никеля на железо означает сокращение возможных циклов включений-выключений при преодолении
барьера в 600°C. Никель от того и дорог, что его невозможно заменить железом. Это относиться ко всем нихромам и фехралям без
исключения. Частое желание заказчика съэкономить на исходном материале оборачивается серьезными затратами при частой замене нагревательных
элементов, работающих вне своих технологических режимов.
 Бывает двух видов, нихром-80 и нихром-60. Немного различаются удельным сопротивлением, различаются процентным содержанием никеля и хрома.
Бывает двух видов, нихром-80 и нихром-60. Немного различаются удельным сопротивлением, различаются процентным содержанием никеля и хрома. Руководство по материалам электротехники ч.3
Руководство по материалам электротехники ч.3 Это максимум составляет 47% при температуре эвтектики и снижается до примерно 30% при комнатной температуре.На основе этого твердого раствора основан ряд коммерческих никель-хромовых сплавов. Такие никель-хромовые сплавы обладают превосходной стойкостью к высокотемпературному окислению и коррозии и хорошей износостойкостью.
Это максимум составляет 47% при температуре эвтектики и снижается до примерно 30% при комнатной температуре.На основе этого твердого раствора основан ряд коммерческих никель-хромовых сплавов. Такие никель-хромовые сплавы обладают превосходной стойкостью к высокотемпературному окислению и коррозии и хорошей износостойкостью. Типичное применение — нагревательные элементы, термопары и другие приложения, связанные с высокой температурой воды и коррозией.
Типичное применение — нагревательные элементы, термопары и другие приложения, связанные с высокой температурой воды и коррозией.